

| 烃 | CH4 | CH3CH3 | CH3(CH2)2CH3 | 硝基苯酚 |  |  | 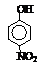 |
| 沸点/℃ | -164 | -88.6 | -0.5 | 熔点/℃ | 45 | 96 | 114 |
| 2 |
| 3 |
 ,COCl2分子中C原子与Cl原子以单键相结合,与O原子以双键相结合,C=O键中含有1个δ键,1个π键,则COCl2分子内含有3个σ键、1个π键,所以C原子为sp2杂化,
,COCl2分子中C原子与Cl原子以单键相结合,与O原子以双键相结合,C=O键中含有1个δ键,1个π键,则COCl2分子内含有3个σ键、1个π键,所以C原子为sp2杂化,| 2 |
| 3 |


科目:高中化学 来源: 题型:
A、氯化氢的电子式H+[:
| ||||
B、镁的原子结构示意图 | ||||
| C、次氯酸的结构式 H-Cl-O | ||||
| D、实验室制取氯气的离子方程式MnO2+4HCl(浓)=Cl2+Mn2++2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:

 可用于制备一种重要的有机化工原料水杨酸
可用于制备一种重要的有机化工原料水杨酸 ,使用流程图表示其制备过程.(流程图示例:CH3CH2OH
,使用流程图表示其制备过程.(流程图示例:CH3CH2OH| 浓硫酸 |
| 170℃ |
| Br2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、同一主族元素的原子,最外层电子数相同,化学性质完全相同 |
| B、同主族元素含氧酸性随核电核数的增加而减弱 |
| C、元素周期表是元素原子核外电子排布周期性变化的结果 |
| D、非金属元素形成的共价化合物中,原子的外层电子数只能是2或8 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、平衡常数越大,则H2转化率越大 |
| B、平衡常数越小,则平衡向逆反应方向移动 |
| C、只改变某一条件使平衡常数增大,则正反应速率增大 |
| D、只改变某一条件使平衡常数减小,则H2转化率减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 A、B、C、X均为中学化学常见物质一定条件下它们有如图转化关系(其他产物已略去).下列说法正确的是( )
A、B、C、X均为中学化学常见物质一定条件下它们有如图转化关系(其他产物已略去).下列说法正确的是( )| A、若X为Fe,则C可能为Fe(NO3 )2 |
| B、若X为KOH溶液,则A可能为Al |
| C、若X为O2,则A可为有机物乙醇,也可为非金属单质硫 |
| D、若A、B、C均为焰色反应呈黄色的化合物,则X一定为CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、 |
B、 |
C、 |
D、 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com