
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
(共15分) I(9分)写出下列热化学反应方程式
(1)N2 (g)与H2(g)反应生成1molNH3(g),放出46.1KJ热量。
(2)1molC2H5OH(l)完全燃烧生成CO2(g)和H2O(l),放出1366.8KJ热量。
(3)1molC(石墨)与适量H2O(g)反应吸收131.3KJ热量
II .(6分)(1)化学反应中均伴随着能量的变化,化学键的断裂和形成是发生能量变化的主要原因。生成物中化学键形成时会__________能量(填“放出”或“吸收”);如果一个化学反应,化学键断裂时的能量变化大于化学键形成时的能量变化,则该反应属于_________反应;如果一个化学反应,反应物的总能量和生成物的总能量有如图所示的关系,则该反应属于__________反应。
(2)不同形式的能量可以相互转换,如:化学能和电能、热能之间的相互转换。如图是一个原电池工作原理的示意图。试回答:
①从能量角度看,它属于____________能转化为____________能;
②装置中Zn为____________极。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年山东省鲁北中学高二上学期期中考试化学试卷 题型:填空题
(共18分)I(6分)写出下列热化学反应方程式
(1)N2 (g)与H2(g)反应生成1molNH3(g),放出46.1KJ热量。
(2)1molC2H5OH(l)完全燃烧生成CO2(g)和H2O(l),放出1366.8KJ热量。
(3)1molC(石墨)与适量H2O(g)反应吸收131.3KJ热量
II.(12分)(1)化学反应中均伴随着能量的变化,化学键的断裂和形成是发生能量变化的主要原因。生成物中化学键形成时会__________能量(填“放出”或“吸收”);如果一个化学反应,化学键断裂时的能量变化大于化学键形成时的能量变化,则该反应属于_________反应; 如果一个化学反应,反应物的总能量和生成物的总能量有如图所示的关系,则该反应属于__________反应。
如果一个化学反应,反应物的总能量和生成物的总能量有如图所示的关系,则该反应属于__________反应。
(2)不同形式的能量可以相互转换,如:化学能和电能、热能之间的相互转换。如图是一个原电池工作原理的示意图。试回答:
①从能量角度看,它属于____________能转化为____________能;
②装置中Zn为____________极。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年山东省济宁市邹城二中高二上学期期中质量检测化学试卷 题型:填空题
(共15分) I(9分)写出下列热化学反应方程式
(1)N2 (g)与H2(g)反应生成1molNH3(g),放出46.1KJ热量。
(2)1molC2H5OH(l)完全燃烧生成CO2(g)和H2O(l),放出1366.8KJ热量。
(3)1molC(石墨)与适量H2O(g)反应吸收131.3KJ热量
II .(6分)(1)化学反应中均伴随着能量的变化,化学键的断裂和形成是发生能量变化的主要原因。生成物中化学键形成时会__________能量(填“放出”或“吸收”);如果一个化学反应,化学键断裂时的能量变化大于化学键形成时的能量变化,则该反应属于_________反应;如果一个化学反应,反应物的总能量和生成物的总能量有如图所示的关系,则该反应属于__________反应。
(2)不同形式的能量可以相互转换,如:化学能和电能、热能之间的相互转换。如图是一个原电池工作原理的示意图。试回答:
①从能量角度看,它属于____________能转化为____________能;
②装置中Zn为____________极。[来源:学,科,网]
查看答案和解析>>
科目:高中化学 来源:2013届山东省潍坊市高二寒假作业化学(一)试卷 题型:填空题
利用化学反应原理研究生产、生活中的实际问题具有十分重要的意义:
(Ⅰ)氮气和氢气合成氨是化学工业中极为重要的反应,其热化学方程式可表示为:N2(g)+3H2(g)  2NH3(g) ΔH=-92 kJ·mol-1。请回答下列问题:
2NH3(g) ΔH=-92 kJ·mol-1。请回答下列问题:
(1)取1 mol N2(g)和3 mol H2(g)放在一密闭容器中,在催化剂存在时进行反应,测得反应放出的热量_____92 kJ(填“大于”“等于”或“小于”),原因是_______;若加入催化剂,ΔH (填“变大”“变小”或“不变”)。
(2)已知:分别破坏1 mol N≡N键、1 mol H—H键需要吸收的能量为:946 kJ、436 kJ,则破坏1 mol N—H键需要吸收的能量为______kJ。
(3)N2H4可视为:NH3分子中的H被—NH2取代的产物。发射卫星用N2H4(g)为燃料,NO2为氧化剂生成N2和H2O(g)。
已知:N2(g)+2O2(g)===2NO2(g) ΔH1=+67.7 kJ·mol-1
N2H4(g)+O2(g)===N2(g)+2H2O(g) ΔH2=-534 kJ·mol-1。
则:1 mol N2H4完全反应的热化学方程式为 。
(Ⅱ)某铅蓄电池的正、负极标记被磨损。试用下图装置设计实验,识别出此铅蓄电池的正负极。
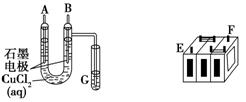
(1)若A接E,B接F,而B电极出现 ,反应式为 ,则说明F为正极;
(2)若铅蓄电池工作时(放电),其E所在电极的电极反应式为: ,充电时该极与外加电源的 极相连。
(3)若用该电池电解Cu(NO3)2 溶液,其电解方程式为
若有0.2mol电子发生转移,则正极消耗的PbO2的物质的量是 ;要想CuSO4溶液恢复原样,需加入的物质是 ,质量为
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com