
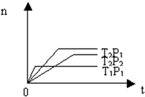
 反应2X(g)+Y(g)?2Z(g);△H<0(正反应为放热反应),在不同温度(T1和T2)及压强(P1和P2)下,产物Z的物质的量[n(Z)]与反应时间(t)的关系如图所示.则下列判断正确的是( )
反应2X(g)+Y(g)?2Z(g);△H<0(正反应为放热反应),在不同温度(T1和T2)及压强(P1和P2)下,产物Z的物质的量[n(Z)]与反应时间(t)的关系如图所示.则下列判断正确的是( )| A、T1<T2,P1<P2 |
| B、T1<T2,P1>P2 |
| C、T1>T2,P1>P2 |
| D、T1>T2,P1<P2 |
 期末好成绩系列答案
期末好成绩系列答案 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案科目:高中化学 来源: 题型:
| A、氢氧化铁溶于氢碘酸:Fe(OH)3+3H+=Fe3++3H2O |
| B、硫酸铜溶液显酸性:Cu2++2H2O═Cu(OH)2↓+2H+ |
| C、向碳酸氢铵溶液中加过量石灰水并加热:NH4++OH-=NH3↑+H2O |
| D、用酸化的高锰酸钾溶液氧化双氧水:2MnO4-+6H++5H2O2=2Mn2++5O2↑+8H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
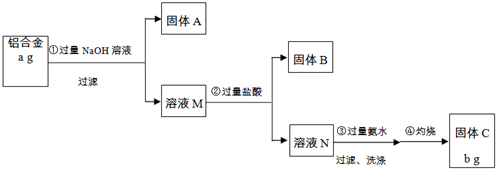
查看答案和解析>>
科目:高中化学 来源: 题型:
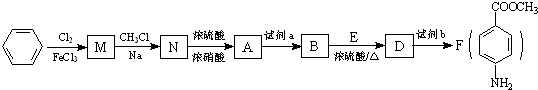
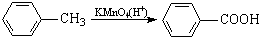


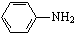 最多能够和
最多能够和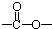 结构;
结构;查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
| 1 |
| 2 |
| A、-285.8kJ/mol |
| B、285.8kJ/mol |
| C、-241.8kJ/mol |
| D、241.8kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、950 mL,111.2 g |
| B、500 mL,117 g |
| C、1 000 mL,117 g |
| D、1 000 mL,111.2 g |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、生成乙烯的是热的氢氧化钾的水溶液 |
| B、生成乙醇的是热的氢氧化钾的水溶液 |
| C、生成乙烯的是在170℃下进行的 |
| D、生成乙醇的是热的氢氧化钾的醇溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| H+ |
| ①转化 |
| Fe2+ |
| ②还原 |
| OH- |
| ③沉淀 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com