
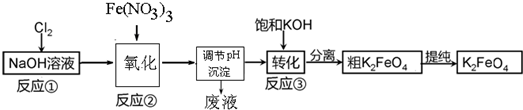

分析 (1)三价铁离子水解产生氢氧化铁胶体,胶体表面积大,吸附能力强,达到净水目的;
(2)当Al(OH)3开始沉淀时,溶液中$\frac{c(F{e}^{3+})}{c(A{l}^{3+})}$=$\frac{c(Fe{\;}^{3+}){c}^{3}(O{H}^{-})}{c(Al{\;}^{3+}){c}^{3}(O{H}^{-})}$=$\frac{Ksp[Fe(OH){\;}_{3}]}{Ksp[Al(OH){\;}_{3}]}$,据此计算;
(3)①氯气与氢氧化钠反应产生强氧化剂次氯酸钠,硝酸铁水解产生氢氧化铁胶体,次氯酸钠将氢氧化铁氧化成高铁酸钠,据此写出氧化过程的离子方程式;已知高铁酸盐热稳定性差,在实际生产中一般控制反应温度30℃以下,其原因是防止生成的高铁酸钠发生分解;
②加入浓KOH溶液可析出高铁酸钾(K2FeO4),说明该温度下,高铁酸钾的溶解度比高铁酸钠的溶解度小;
③洗涤滤渣的方法是,将滤渣放在过滤装置中,用玻璃棒将蒸馏水引流至过滤装置中,让蒸馏水浸没沉淀,使水自然流下,重复操作2~3 次;
④Cl2生成ClO-、ClO3-化合价升高,是被氧化的过程,而Cl2生成NaCl是化合价降低被还原的过程,氧化还原反应中氧化剂和还原剂之间得失电子数目相等,据ClO-与ClO3-的物质的量浓度之比可计算出失去电子的总物质的量,进而可计算得到电子的总物质的量;再根据氯元素被还原生成KCl的化合价变化为1计算出被还原的氯元素的物质的量,最后计算出被还原的氯元素和被氧化的氯元素的物质的量之比;
(4)依据阳极是铁,故阳极上铁放电生成FeO42-结合碱性环境来写出电极方程式;根据OH-在阳极被消耗,而在阴极会生成来分析.
解答 解:(1)三价铁离子水解产生氢氧化铁胶体,离子方程式为:Fe3++3H2O?Fe(OH)3(胶体)+3H+,胶体表面积大,吸附能力强,达到净水目的,
故答案为:Fe3++3H2O?Fe(OH)3(胶体)+3H+;
(2)当Al(OH)3开始沉淀时,溶液中$\frac{c(F{e}^{3+})}{c(A{l}^{3+})}$=$\frac{c(Fe{\;}^{3+}){c}^{3}(O{H}^{-})}{c(Al{\;}^{3+}){c}^{3}(O{H}^{-})}$=$\frac{Ksp[Fe(OH){\;}_{3}]}{Ksp[Al(OH){\;}_{3}]}$=$\frac{4.0×10{\;}^{-38}}{1.0×10{\;}^{-33}}$=4×10-5,
故答案为:4×10-5;
(3)①氯气与氢氧化钠反应产生强氧化剂次氯酸钠,硝酸铁水解产生氢氧化铁胶体,次氯酸钠将氢氧化铁氧化成高铁酸钠,离子方程式为:2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O;已知高铁酸盐热稳定性差,在实际生产中一般控制反应温度30℃以下,其原因是防止生成的高铁酸钠发生分解,
故答案为:2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O;防止生成的高铁酸钠发生分解;
②加入浓KOH溶液可析出高铁酸钾(K2FeO4),说明该温度下,高铁酸钾的溶解度比高铁酸钠的溶解度小,
故答案为:该温度下,高铁酸钾的溶解度比高铁酸钠的溶解度小;
③洗涤滤渣的方法是,将滤渣放在过滤装置中,用玻璃棒将蒸馏水引流至过滤装置中,让蒸馏水浸没沉淀,使水自然流下,重复操作2~3 次,
故答案为:用玻璃棒将蒸馏水引流至过滤装置中,让蒸馏水浸没沉淀,使水自然流下,重复操作2~3 次;
④Cl2生成ClO-与ClO3-是被氧化的过程,化合价分别由0价升高为+1价和+5价,
经测定ClO-和ClO3-物质的量之比为1:2,
则可设ClO-为1mol,ClO3-为2mol,被氧化的氯元素的物质的量为:1mol+2mol=3mol,
根据化合价变化可知,反应中失去电子的总物质的量为:1mol×(1-0)+2mol×(5-0)=11mol,
氧化还原反应中得失电子数目一定相等,则该反应中失去电子的物质的量也是11mol,
Cl2生成KCl是被还原的过程,化合价由0价降低为-1价,
则被还原的Cl的物质的量为:$\frac{11mol}{1-0}$=11mol,
所以被还原的氯元素和被氧化的氯元素的物质的量之比为11mol:3mol=11:3,
故答案为:11:3;
(4)阳极是铁,故阳极上铁放电生成FeO42-,由于是碱性环境,故电极方程式为:Fe+8OH--6e-=FeO42-+4H2O,
在电解时,水电离的H+在阴极放电:2H++2e-=H2↑,c(OH-)增大,Na+通过阳离子交换膜进入阴极区,使阴极区c(NaOH)增大,故NaOH可以循环使用,
故答案为:Fe+8OH--6e-=FeO42-+4H2O;NaOH溶液.
点评 本题考查了三价铁离子与Na2FeO4的净水原理,涉及难溶电解质的计算、氧化还原反应方程的书写、计算、电极反应的书写,综合性强,有一定难度,Na2FeO4的净水是常考点,应注意归纳总结.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 三者的单质直接与O2反应都能生成两种以上的氧化物 | |
| B. | CO2、NO2、SO2都能与H2O发生化合反应 | |
| C. | CO2、NO2、SO2都是大气污染气体,在空气中都能稳定存在 | |
| D. | 三种元素在自然界中既有游离态又有化合态 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题

| 物质 | 熔点 | 沸点 | 溶解度 |
| 乙酰苯胺 | 114.3℃ | 305℃ | 微溶于冷水、易溶于热水 |
| 苯胺 | -6℃ | 184.4℃ | 微溶于水 |
| 醋酸 | 16.6℃ | 118℃ | 易溶于水 |

查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 ;
; .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com