
分析 (1)根据盖斯定律:②=③-①得反应②的△H2;
(2)依据反应①+②得到反应③,所以平衡常数K3=K1×K2,依据某时刻浓度商计算和平衡常数比较判断反应进行的方向;
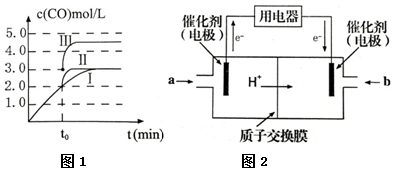
(3)图象分析曲线Ⅰ变化为曲线Ⅱ是缩短反应达到平衡的时间,最后达到相同平衡状态,体积是可变得是恒压容器,说明改变的是加入了催化剂;曲线I变为曲线III时,一氧化碳的浓度由0.3mol/L变为0.45mol/L,容器的体积由3L变为2L;
(4)根据题给装置知本题考查酸性甲醇燃料电池,根据外电路电子流向判断左侧电极为电池的负极,发生氧化反应;
(5)溶液等体积混合溶质浓度减少一半,醋酸电离平衡常数与浓度无关,结合概念计算.
解答 解:(1)已知反应①:CO(g)+2H2(g)?CH3OH(g)△H1=-90.77kJ/mol,反应②:CO2(g)+H2(g)?CO(g)+H2O(g)△H2,反应③:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H3=-49.58kJ/mol,根据盖斯定律:②=③-①得反应②的△H2=+41.19 kJ•mol-1,
故答案为:+41.19 kJ•mol-1;
(2)根据已知反应确定K1=c(CH3OH)/c(CO)c2(H2)、K2=c(CO)c(H2O)/c(CO2)c(H2)、K3=c(CH3OH) c(H2O)/c(CO2)c3(H2),则K3=K1•K2,500℃时K1、K2的值分别为2.5、1.0,则K3=K1•K2=2.5,该温度下反应③在某时刻,Q=$\frac{c(C{H}_{3}OH)c({H}_{2}O)}{c(C{O}_{2}){c}^{3}({H}_{2})}$=$\frac{0.3×0.15}{0.1×0.{8}^{3}}$=0.9<K3,反应正向进行,则此时V正>V逆.
故答案为:>;
(3)分析图象知t0时刻改变一个条件,曲线I变为曲线II,一氧化碳的平衡浓度没有变化而达平衡的时间缩短,改变的条件是加入催化剂;反应②为反应前后气体物质的量不变的反应,改变压强,平衡不移动,曲线I变为曲线III时,一氧化碳的浓度由0.3mol/L变为0.45mol/L,容器的体积由3L变为2L.
故答案为:加入催化剂; 2L;
(4)根据题给装置知本题考查酸性甲醇燃料电池,根据外电路电子流向判断左侧电极为电池的负极,发生氧化反应,即甲醇被氧化为二氧化碳,结合碳元素的化合价变化确定失电子数目,根据原子守恒和电荷守恒配平,电极反应式为CH3OH-6e-+H2O=CO2+6H+.
故答案为:CH3OH-6e-+H2O=CO2+6H+;
(5)通常状况下,将a mol/L的醋酸与b mol/L Ba(OH)2溶液等体积混合,溶液中溶质为醋酸钡和氢氧化钡,反应平衡时,2c(Ba2+)=c(CH3COO-)=bmol/L,溶液中c(H+)=c(OH-)=10-7mol/L,溶液呈中性,醋酸电离平衡常数依据电离方程式写出K=$\frac{c(C{H}_{3}CO{O}^{-})×c({H}^{+})}{c(C{H}_{3}COOH)}$=$\frac{b×1{0}^{-7}}{\frac{a}{2}-b}$=$\frac{2b}{a-2b}$×10-7L/mol;
故答案为:$\frac{2b}{a-2b}$×10-7L/mol.
点评 本题考查了化学平衡影响因素分析判断,平衡常数计算和影响条件的应用,难溶电解质溶液中溶度积的计算,题目综合性较大.


 教学练新同步练习系列答案
教学练新同步练习系列答案 课前课后同步练习系列答案
课前课后同步练习系列答案 课堂小作业系列答案
课堂小作业系列答案 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案科目:高中化学 来源: 题型:解答题
| 元素代号 | X | Y | Z | M | R |
| 原子半径/nm | 0.186 | 0.102 | 0.075 | 0.074 | 0.143 |
| 主要化合价 | +1 | +6-2 | +5-3 | -2 | +3 |
 ;所含化学键类型离子键、共价键.
;所含化学键类型离子键、共价键.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含氧酸的酸性、氢化物的沸点:W>Z | |
| B. | 原子半径:X>Y>W | |
| C. | X的氢化物、X2W溶于水后所得溶液都呈碱性 | |
| D. | Z的最高价氧化物常用作光导纤维 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
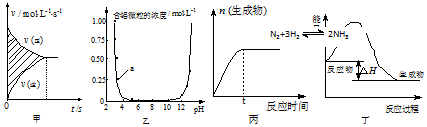
| A. | 图甲中阴影部分的面积表示v(正)与v (逆)的差值N2+3H2?2NH3 | |
| B. | 图乙表示溶液中含铝微粒浓度随pH变化曲线,a点所示溶液中存在大量AlO2- | |
| C. | 图丙表示一定条件下,该反应t时刻N2的转化率最大 | |
| D. | 图丁表示某吸热反应的能量变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 催化还原CO2是解决温室效应及能源问题的重要手段之一.研究表明,在Cu/ZnO催化剂存在下,CO2和H2可发生两个反应,分别生成CH3OH和CO.反应的热化学方程式如下:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H1=-53.7kJ•mol-1 I CO2(g)+H2(g)?CO(g)+H2O(g)△H2Ⅱ
催化还原CO2是解决温室效应及能源问题的重要手段之一.研究表明,在Cu/ZnO催化剂存在下,CO2和H2可发生两个反应,分别生成CH3OH和CO.反应的热化学方程式如下:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H1=-53.7kJ•mol-1 I CO2(g)+H2(g)?CO(g)+H2O(g)△H2Ⅱ| T(K) | 催化剂 | CO2转化率(%) | 甲醇选择性(%) |
| 543 | Cat.1 | 12.3 | 42.3 |
| 543 | Cat.2 | 10.9 | 72.7 |
| 553 | Cat.1 | 15.3 | 39.1 |
| 553 | Cat.2 | 12.0 | 71.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
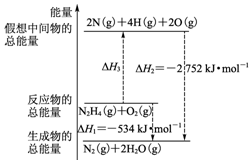 断裂1mol化学键所需的能量如表:
断裂1mol化学键所需的能量如表:| 化学键 | N-N | O=O | N≡N | N-H |
| 键能(kJ) | 154 | 500 | 942 | a |
| A. | N2比O2稳定 | |
| B. | N2H4(g)+O2(g)?N2(g)+2H2O(g)△H=-534 kJ•mol-1 | |
| C. | 表中的a=194 | |
| D. | 图中的△H3=+2218 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
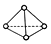 ,它是一种非极性分子.(填“极性”或“非极性”)
,它是一种非极性分子.(填“极性”或“非极性”)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
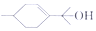 的说法不正确的是( )
的说法不正确的是( )| A. | 有机物的分子式是C10H18O | B. | 能与溴水、钠发生反应 | ||
| C. | 能发生氧化、取代反应 | D. | 与HC1发生加成的产物只有1种 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com