
| A. | CH3CH(CH2Br)2 | B. | (CH3)2BrCH2Br | C. | C2H5CHBrCH2Br | D. | CH3(CHBr)2CH3 |
分析 C4H10O发生消去反应生成C4H8,则C4H8为烯烃,判断C4H8属于烯烃的可能的同分异构体,再根据烯烃与溴发生加成反应,碳碳双键其中1个键断裂,不饱和的碳原子结合溴原子生成二溴代烷,据此判断.
解答 解:C4H10O发生消去反应生成C4H8,C4H8属于烯烃的可能的同分异构体,有CH2═CH2CH2CH3、CH3CH═CHCH3、CH2═C(CH3)2.
A.C4H8为烯烃,与溴发生加成反应后溴原子处于相邻的2个碳原子上,故A选;
B.CH2═C(CH3)2与溴发生加成反应后溴原子处于相邻的2个碳原子上,得到(CH3)2C Br CH2 Br,故B不选;
C.CH2═CH2CH2CH3与溴发生加成反应后溴原子处于相邻的2个碳原子上,即得到C2H5CHBrCH2Br,故C不选;
D.若为CH3CH═CHCH3,则与溴加成生成CH3CHBrCHBrCH3,故D不选;
故选A.
点评 本题考查有机物的推断,题目难度中等,本题侧重于有机物之间转化为载体,考查同分异构体、加成反应、有机物性质等,关键判断C4H8属于烯烃的可能的同分异构体及理解加成反应机理.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 增大c(CH3COCH3) | B. | 增大c(I2) | C. | 升高温度 | D. | 增大压强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na | B. | Mg | C. | Al | D. | Zn |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
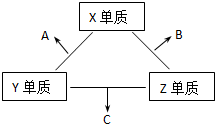 X、Y、Z三种短周期元素,它们的原子序数之和为16.X、Y、Z三种元素的常见单质在常温下都是无色气体,在适当条件下可发生如下变化:
X、Y、Z三种短周期元素,它们的原子序数之和为16.X、Y、Z三种元素的常见单质在常温下都是无色气体,在适当条件下可发生如下变化: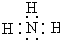 ,C分子的结构呈三角锥形.
,C分子的结构呈三角锥形.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下浓硫酸能使铝发生钝化,可在常温下用铝制容器贮藏贮运浓硫酸 | |
| B. | 氯气具有强氧化性,因此可用于漂白有色布料 | |
| C. | NH3能与Cl2生成NH4Cl,可用浓氨水检验输送氯气的管道是否有泄漏 | |
| D. | 氢氟酸能与二氧化硅反应,因此可用于刻蚀玻璃 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ).实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成乙酰水杨酸,制备的主要反应为:
).实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成乙酰水杨酸,制备的主要反应为: +(CH3CO)2O$→_{85-90℃}^{浓硫酸}$
+(CH3CO)2O$→_{85-90℃}^{浓硫酸}$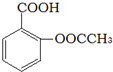 +CH3COOH操作流程如下:
+CH3COOH操作流程如下:
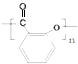 .
.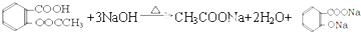 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同主族元素的原子半径越大,熔点越高 | |
| B. | 在元素周期表中,s区,d区和ds区的元素都是金属 | |
| C. | 石墨晶体中的作用力有共价键、金属键两种,是一种混合晶体 | |
| D. | 在晶体中只要有阴离子就一定有阳离子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com