
【题目】下列操作能达到预期目的的是
A.将苯和溴水混合后加入铁粉制取溴苯B.用金属钠区分乙醇和乙醚
C.用酸性高锰酸钾溶液除去乙炔中含有的 H2SD.将敞口久置的电石与饱和食盐水混合制乙炔
科目:高中化学 来源: 题型:
【题目】两种金属粉末的混合物12g,投入足量的稀硫酸中,在标准状况下产生11.2L气体,则这种混合物可能是( )
A. Zn、Al B. Fe、Zn C. Al、Mg D. Mg、Cu
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质中,既能因发生化学反应使溴水褪色,又能使酸性KMnO4溶液褪色的是
①SO2 ②CH3CH2CH=CH2 ③![]() ④ CH3CH3
④ CH3CH3
A. ①②③④B. ③④
C. ①②④D. ①②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.SiO2是酸性氧化物,不跟任何酸反应
B.水玻璃敞口存放,不可能有白色胶状沉淀析出
C.高温时SiO2能跟Na2CO3反应放出CO2,所以硅酸的酸性比碳酸强
D.SiO2不溶于水,也不能与水反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有机物在酸性催化条件下发生水解反应, 生成两种不同的有机物, 且这两种有机物的相对分子质量相等, 该有机物可能是
A.蔗糖B.麦芽糖C.乙酸乙酯D.甲酸乙酯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应速率、化学平衡理论通过大量化学实验进行验证,回答下列相关实验问题。
(1)、Cr2![]() 在溶液中与
在溶液中与![]() 存在一平衡体系,若向体系中加入足量70%的硫酸,溶液呈______色,平衡体系的离子方程式________________________。
存在一平衡体系,若向体系中加入足量70%的硫酸,溶液呈______色,平衡体系的离子方程式________________________。
(2)、探究酸性条件下影响KI溶液被空气氧化的快慢因素,通过观察___________浓度变化比较速率快慢的,KI被氧化的离子方程式___________________。
(3)根据硫代硫酸钠与酸反应探究多种条件对反应速率的影响,下表各组实验中最快出现浑浊的是______;反应离子方程式_________________________________.
Na2S2O3溶液 | 稀H2SO4 | H2O | 温度/℃ | |||
c/mol· | V/mL | c/mol· | V/mL | V/mL | ||
A | 0.1 | 5 | 0.5 | 5 | 10 | 10 |
B | 0.2 | 5 | 0.1 | 5 | 10 | 10 |
C | 0.1 | 5 | 0.1 | 5 | 10 | 30 |
D | 0.2 | 5 | 0.1 | 5 | 10 | 30 |
(4)某化学小组为了研究外界条件对化学反应速率的影响,进行了如下实验:
(实验内容及记录)
实验编号 | 室温下,试管中所加试剂及其用量/mL | 室温下溶液颜色褪至无色所需时间/min | |||
0.6 mol/LH2C2O4溶液 | H2O | 0.2 mol/LKMnO4溶液 | 3 mol/L稀硫酸 | ||
1 | 3.0 | V | 3.0 | 2.0 | 4.0 |
2 | 3.0 | 3.0 | 2.0 | 2.0 | 5.2 |
3 | 3.0 | 4.0 | 1.0 | 2.0 | 6.4 |
请回答:
①根据实验试剂写出实验原理:_____________________(用离子方程式表示)
②分析上述表中的实验数据。V=___mL.实验中加水的目的是________________.
③利用实验1中数据计算,用KMnO4的浓度变化表示的反应速率v(KMnO4)=__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是部分短周期主族元素原子半径与原子序数的关系图。下列说法正确的是

A. Z、N两种元素的离子半径相比,前者大
B. X、N两种元素的氢化物的沸点相比,前者较低
C. M比X的原子序数多7
D. Z单质均能溶解于Y的氢氧化物和N的氢化物的水溶液中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有科学家提出硅是“21世纪的能源”、“未来的石油”的观点。假如硅作为一种普遍使用的新型能源被开发利用,下列关于其有利因素的说法中,你认为不妥的是
A. 便于运输、储存,从安全角度考虑,硅是最佳的燃料
B. 自然界的含硅化合物易开采
C. 硅燃烧放出的热量大,燃烧产物对环境污染程度低且容易有效控制
D. 自然界中存在大量单质硅
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以Cl2、NaOH、(NH2)2CO(尿素)和SO2为原料可制备N2H4·H2O(水合肼)和无水Na2SO3,其主要实验流程如下:
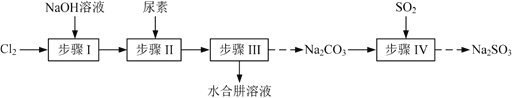
已知:①Cl2+2OH![]() ClO+Cl+H2O是放热反应。
ClO+Cl+H2O是放热反应。
②N2H4·H2O沸点约118 ℃,具有强还原性,能与NaClO剧烈反应生成N2。
(1)步骤Ⅰ制备NaClO溶液时,若温度超过40 ℃,Cl2与NaOH溶液反应生成NaClO3和NaCl,其离子方程式为____________________________________;实验中控制温度除用冰水浴外,还需采取的措施是____________________________________。
(2)步骤Ⅱ合成N2H4·H2O的装置如题图1所示。NaClO碱性溶液与尿素水溶液在40 ℃以下反应一段时间后,再迅速升温至110 ℃继续反应。实验中通过滴液漏斗滴加的溶液是_____________;使用冷凝管的目的是_________________________________。
(3)步骤Ⅳ用步骤Ⅲ得到的副产品Na2CO3制备无水Na2SO3(水溶液中H2SO3、![]() 、
、![]() 随pH的分布如题图2所示,Na2SO3的溶解度曲线如题图3所示)。
随pH的分布如题图2所示,Na2SO3的溶解度曲线如题图3所示)。
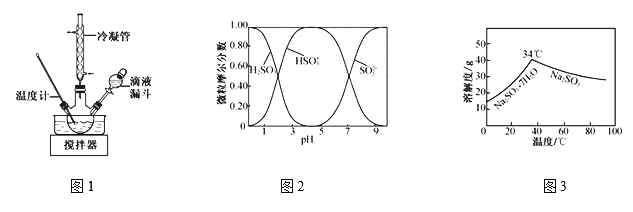
①边搅拌边向Na2CO3溶液中通入SO2制备NaHSO3溶液。实验中确定何时停止通SO2的实验操作为_________________。
②请补充完整由NaHSO3溶液制备无水Na2SO3的实验方案: _______________________,用少量无水乙醇洗涤,干燥,密封包装(结合图2、图3说明)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com