
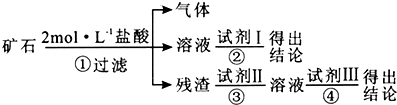
| 编号 | 实验操作 | 预期现象和结论 |
| ① | 取适量矿石研细,加 足量2 mol•L-1盐酸 | 有大量无色气体生成,得棕黄 色溶液,且仍有少量固体残留 |
| ② | ||
| ③ | ||
| ④ |
分析 矿石部分溶解,并有大量无色无味气体生成,则一定含CaCO3、SiO2,如检验是否含有Fe2O3,可在反应后的溶液中加入KSCN溶液,残渣加入氢氧化钠溶液,SiO2与NaOH反应,与盐酸不反应,硅酸盐与盐酸反应生成白色的硅酸沉淀,以此解答该题.
解答 解:(1)Fe2O3可溶于盐酸,Fe3+存在于溶液中,可用SCN-检验,从而说明矿石含Fe2O3.SiO2不溶于盐酸,作为残渣被滤出.为进一步确认,是否存在SiO2,加入NaOH溶液,充分反应后,再加盐酸,如果生成了白色胶状沉淀则其为H2SiO3,说明矿石中有SiO2,
故答案为:2%的KSCN溶液;2 mol•L-1 NaOH溶液;2 mol•L-1盐酸;
(2)检验矿石中含有Fe2O3,与盐酸反应生成氯化铁,取少量上述流程中的Ⅰ,加入2%KSCN溶液,溶液变为血红色,则含有氧化铁,
检验是否含有二氧化硅,取①操作得残余固体适量置于烧杯中,加入足量2 mol•L-1NaOH溶液,充分搅拌,残余固体完全溶解于2 mol•L-1NaOH溶液,并得无色溶液,
然后取③操作得无色溶液少许置于洁净试管中,用胶头滴管滴入2 mol•L-1盐酸至过量,有白色胶状沉淀,且不溶于过量盐酸,可说明含有二氧化硅,
故答案为:
| ② | 取①操作得溶液少许置于洁净试管中,并滴加几滴2%的KSCN溶液 | 溶液变为红色,说明原矿石可能含有Fe2O3 |
| ③ | 取①操作得残余固体适量置于烧杯中,加入足量2 mol•L-1NaOH溶液,充分搅拌 | 残余固体完全溶解于2 mol•L-1NaOH溶液,并得无色溶液 |
| ④ | 取③操作得无色溶液少许置于洁净试管中,用胶头滴管滴入2 mol•L-1盐酸至过量 | 有白色胶状沉淀,且不溶于过量盐酸,说明原矿石中可能含有SiO2 |
点评 本题考查物质的鉴别和检验,为高频考点,把握物质的性质及实验中发生的反应为解答的关键,注意现象与结论的分析,侧重分析与实验能力的考查,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 一个可逆反应达到的平衡状态就是这个反应在该条件下所能达到的限度 | |
| B. | 增大反应物浓度,能增大活化分子百分数,所以反应速率增大 | |
| C. | 在化学反应过程中,发生物质变化的同时不一定发生能量变化 | |
| D. | 100 mL 2 mol/L的盐酸跟锌片反应,加入适量的氯化钠溶液,反应速率不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
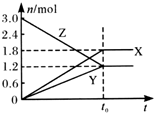 在一定温度下,将一定量的气体通入体积为2 L的密闭容器中,使其发生反应,有关物质X、Y、Z的物质的量的变化如图所示.则下列有关推断正确的是( )
在一定温度下,将一定量的气体通入体积为2 L的密闭容器中,使其发生反应,有关物质X、Y、Z的物质的量的变化如图所示.则下列有关推断正确的是( )| A. | 该反应的化学方程式为:3Z═3X+2Y | B. | t0时,X、Y、Z的质量不再改变 | ||
| C. | t0时,Z的浓度为1.2 mol/L | D. | t0时,反应停止,反应速率为0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
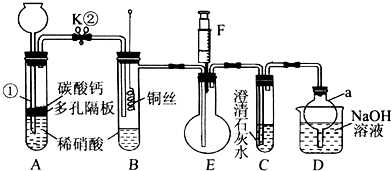
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
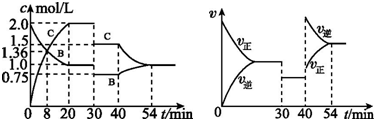
| A. | 30 min~40 min 间该反应使用了催化剂 | |
| B. | 反应方程式中的x=2,正反应为吸热反应 | |
| C. | 30 min 时条件的变化是降低压强,40 min 时条件的变化是升高温度 | |
| D. | 前8 min A 的平均反应速率为0.08 mol•L-1•min-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3(m-n) mL | B. | $(m+\frac{n}{3})$ mL | C. | $\frac{n-m}{3}$ mL | D. | $\frac{4n-m}{12}$ mL |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稀硝酸和碳酸钠 | B. | 氧化铜和稀硝酸 | C. | 碳和浓硫酸 | D. | 铜和浓硝酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(SO3)=0.4 mol/L | B. | c(SO2)=c(SO3)=0.15 mol/L | ||
| C. | c(O2)=0.35 mol/L | D. | c(SO2)+c(SO3)=0.4 mol/L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com