
【题目】科学家哈伯因为氨气的合成曾获1918年诺贝尔奖。
(1)写出实验室制取氨气的化学方程式_______________。检验氨气已装满的方法是_______________。
(2)氨气可用如图装置进行喷泉实验,把氨气换成______(填序号)也可形成喷泉实验。
A.二氧化碳 B.氧气 C.氯化氢气体 D.氢气

(3)完成氨催化氧化生成为NO的反应方程式_________,产物NO有毒,不能排入空气中,若将NO和氧气一起通入水中能生成硝酸的化学方程式:________
(4)2.56gCu与足量的浓硝酸反应生成的气体与一定量的O2混合,然后通入水中恰好完全反应无气体剩余,则该氧气的物质的量为____mol。
【答案】2NH4Cl+Ca(OH) 2![]() CaCl2 +2NH3↑ +2H2O 用湿润的红色石蕊试纸靠近集气瓶口,而现象则是试纸变为蓝色 C 4NH3+5O2
CaCl2 +2NH3↑ +2H2O 用湿润的红色石蕊试纸靠近集气瓶口,而现象则是试纸变为蓝色 C 4NH3+5O2![]() 4NO+6H2O 4NO+3O2+2H2O===4HNO3 0.02
4NO+6H2O 4NO+3O2+2H2O===4HNO3 0.02
【解析】
(1)氯化铵和熟石灰在加热条件下反应生成氨气、氯化钙和水,反应的化学方程式为:2NH4Cl+Ca(OH) 2![]() CaCl2 +2NH3↑ +2H2O,氨气为碱性气体,与水反应生成NH3H2O,NH3H2O电离出OH-离子,溶液呈碱性,用湿润的红色石蕊试纸靠近集气瓶口,如果试纸变蓝,则氨气已经收集满,故答案为:2NH4Cl+Ca(OH) 2
CaCl2 +2NH3↑ +2H2O,氨气为碱性气体,与水反应生成NH3H2O,NH3H2O电离出OH-离子,溶液呈碱性,用湿润的红色石蕊试纸靠近集气瓶口,如果试纸变蓝,则氨气已经收集满,故答案为:2NH4Cl+Ca(OH) 2![]() CaCl2 +2NH3↑ +2H2O;用湿润的红色石蕊试纸靠近集气瓶口,而现象则是试纸变为蓝色。
CaCl2 +2NH3↑ +2H2O;用湿润的红色石蕊试纸靠近集气瓶口,而现象则是试纸变为蓝色。
(2)二氧化碳在水中的溶解度小,氧气、氢气难溶于水,均不能形成喷泉,氯化氢气体极易溶于水,能形成喷泉,故选C,故答案为:C。
(3)氨气催化氧化生成一氧化氮和水,反应的化学方程式为:4NH3+5O2![]() 4NO+6H2O,一氧化氮和氧气混合通入在水中恰好反应生成硝酸,反应的化学方程式为:4NO+3O2+2H2O=4HNO3,故答案为:4NH3+5O2
4NO+6H2O,一氧化氮和氧气混合通入在水中恰好反应生成硝酸,反应的化学方程式为:4NO+3O2+2H2O=4HNO3,故答案为:4NH3+5O2![]() 4NO+6H2O,4NO+3O2+2H2O=4HNO3。
4NO+6H2O,4NO+3O2+2H2O=4HNO3。
(4)2.56gCu的物质的量为2.56g÷64g/mol=0.04mol,与足量的浓硝酸反应生成的气体与一定量的O2混合通入水中恰好完全反应无气体剩余生成硝酸,这说明铜失去的电子最终被氧气获得,0.04mol铜失去0.08mol电子,1分子氧气得到4个电子,则根据电子得失守恒可知需要氧气的物质的量为0.08mol÷4=0.02mol,故答案为:0.02。


 科学实验活动册系列答案
科学实验活动册系列答案科目:高中化学 来源: 题型:
【题目】关于共价键的说法正确的是 ( )
A.金属原子在化学反应中只能失去电子,因而不能形成共价键
B.由共价键形成的分子可以是单质分子,也可以是化合物分子
C.共价键只能在不同原子之间形成
D.稀有气体分子中只存在共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢气和氟气反应生成氟化氢的过程中能量变化如图所示。由图可知

A. 生成1 molHF气体放出的热量为270 kJ
B. H2(g)+ F2(g)→ 2HF(l)+ 270 kJ
C. 反应物的总能量大于生成物的总能量
D. 该反应是吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A. 钠的金属性比锂强 B. 碘的非金属性比氯弱
C. ⅤA族中原子半径最小的是氮 D. 第三周期中,金属性最强的是铝
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验过程如图所示:则图③的试管中的现象是
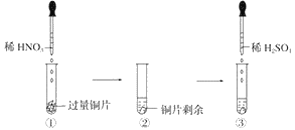
A. 无明显现象,因稀硫酸不与铜反应
B. 铜片溶解,产生无色气体,该气体遇到空气不变色
C. 铜片溶解,放出红棕色有刺激性气味的气体
D. 铜片溶解,产生无色气体,该气体在试管口变为红棕色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是
A. NO2、SO2、BF3、NCl3分子中没有一个分子中原子的最外层电子都满足了8电子稳定结构
B. P4和CH4都是正四面体分子且键角都为109°28′
C. 水分子很稳定与水分子内有氢键有关
D. 晶体熔点由高到低:MgO> H2O > NH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】小刚同学探究二氧化硫分别与BaCl2溶液、Ba(OH)2溶液反应的实验。
(1)少量SO2通入到Ba(OH)2溶液中的离子反应方程式为
________________________________________________________________________,
过量的SO2通入到Ba(OH)2溶液中的离子反应方程式为
________________________________________________________________________。
(2)请回答有关问题。小刚同学将SO2通入到BaCl2溶液中,出现了异常现象,看到了明
显的白色沉淀,为探究该白色沉淀的成分,他设计了如下实验流程:
![]()
![]()
![]()
![]()
![]()
则操作①的名称为________,试剂A的化学式为________。
(3)实验表明,小刚加入试剂A后,白色沉淀未见溶解,则该白色沉淀的成分是________(填化学式),产生该白色沉淀的离子方程式是_________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于在一个密闭容器中进行的反应C(s)+H2O(g)CO(g)+H2(g) 。下列条件的改变对反应速率几乎没有影响的是( )
A. 增加C的量;
B. 减少CO的量;
C. 升高反应体系的温度;
D. 保持压强不变,充入He以增大体积
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,体积一定的密闭容器中发生如下可逆反应:2X(g)+Y(s)![]() 3Z(g) ΔH= QkJ/mol,下列说法正确的是
3Z(g) ΔH= QkJ/mol,下列说法正确的是
A. 消耗2 mol X同时生成3 mol Z,说明达到了平衡状态
B. 加入少量的Y正反应速率加快
C. 气体的密度不变时,说明达到了平衡状态
D. 加入少量的X,Q变大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com