
【题目】解释下列事实的方程式不正确的是( )
A. Al溶于NaOH溶液:2Al + 2H2O + 2NaOH ==2NaAlO2 + 3H2↑
B. 盛放NaOH溶液的试剂瓶不能用玻璃塞:SiO2 + 2OH-=SiO32- + H2O
C. 热的浓NaOH溶液与NH4Cl液混合产生气体:NH4+ + OH-![]() NH3↑+ H2O
NH3↑+ H2O
D. 实验室用NaOH溶液吸收多余的NO2:3NO2 +2OH—=2NO3—+H2O+NO↑
【答案】D
【解析】
A、Al与氢氧化钠溶液反应,Al先与水反应:2Al+6H2O=2Al(OH)3+3H2↑,Al(OH)3再与NaOH反应Al(OH)3+NaOH=NaAlO2+2H2O,两式合并:2Al+2NaOH+2H2O=2NaAlO2+3H2↑,不符合题意;B、玻璃中含有SiO2,玻璃塞是磨口的,SiO2外露SiO2+2OH-=SiO32-+H2O,不符合题意;C、利用NH3·H2O不稳定受热易分解,NH4+ + OH-![]() NH3↑+ H2O,不符合题意;D、用足量的氢氧化钠溶液吸收二氧化氮的离子反应为2NO2+2OH-═NO3-+NO2-+H2O,符合题意。答案选D。
NH3↑+ H2O,不符合题意;D、用足量的氢氧化钠溶液吸收二氧化氮的离子反应为2NO2+2OH-═NO3-+NO2-+H2O,符合题意。答案选D。


 孟建平错题本系列答案
孟建平错题本系列答案 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案科目:高中化学 来源: 题型:
【题目】用含少量银和锌的粗铜做阳极,纯铜片做阴极,CuSO4溶液做电解液,电解一段时间后,阳极质量减少了x g,则( )
A. 电解液质量增加x g B. 阴极质量增加x g
C. 阴极质量增加a g,a>x D. 阴极质量增加b g,b<x
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(题文)由下列实验及现象不能推出相应结论的是
实验 | 现象 | 结论 | |
A | 加热盛有少量NH4HCO3固体的试管,并在试管口放置湿润的红色石蕊试纸 | 石蕊试纸变蓝 | NH4HCO3固体受热分解,产生的NH3与水反应生成的氨水显碱性 |
B | 向2支盛有1 mL相同浓度AgNO3溶液的试管中分别加入3滴相同浓度的KCl和KI溶液 | 一只试管中产生黄色沉淀,另一支中无明显现象 |
|
C | 向苯酚钠溶液中通入CO2 | 溶液变浑浊 | 相同条件下,碳酸的酸性一定比苯酚强 |
D | 用铂丝蘸取少量某溶液进行焰色反应 | 火焰呈黄色 | 证明该溶液中一定存在Na+和K+ |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(化学——选修3:物质结构与性质)
A、B、C、D为原子序数依次增大的四种元索,A2-和B+具有相同的电子构型;C、 D为同周期元索,C核外电子总数是最外层电子数的3倍;D元素最外层有一个未成对电子。回答下列问题:
(1)四种元素中电负性最大的是______(填元素符号),其中D原子的核外电子排布式为__________。
(2)单质A有两种同素异形体,其中沸点高的是______(填分子式),原因是________;B和D的氢化物所属的晶体类型分别为_______和_______。
(3)C和D反应可生成组成比为1:3的化合物E, E的立体构型为_______,中心原子的杂化轨道类型为_______,中心原子的价层电子对数为_____________。
(4)A和B能够形成化合物F,其晶胞结构如图所示,晶胞参数,a=0.566nm, 列式计算晶体F的密度(g.cm-3)______________________________。
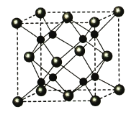
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据要求回答下列有关问题。
(1)已知:①Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g) △H1=+489.0kJ/mol
②Fe2O3(s)+3CO(g)![]() 2Fe(s)+3CO2(g)△H2=-28.0kJ/mol
2Fe(s)+3CO2(g)△H2=-28.0kJ/mol
③C(石墨)+CO2(g)=2CO(g)△H3=akJ/mol
则a=_______kJ/mol。
(2)工业合成氨时,合成塔中每产生1molNH3放出46.1kJ的热量。
某小组研究在500℃下该反应过程中的能量变化。他们分别在体积均为VL的两个恒温恒容密闭容器中加入一定量的反应物,使其在相同温度下发生反应。相关数据如下:
容器 | 起始时各物质物质的量/mol | 达到平衡的时间 | 达平衡时体系能量的变化/kJ | ||
N2 | H2 | NH3 | |||
a | 1 | 4 | 0 | t1min | 放出热量:27.66kJ |
b | 2 | 8 | 0 | t2min | 放出热量:Q |
①容器a中,0~t1时间的平均反应速率为v(H2)=_______。
②容器b中反应达平衡状态时,Q_______55.32kJ;平衡时,容器中H2的转化率:a_______b(填“>”或“<”或“=”)。
(3)以氨为原料,合成尿素的反应原理为:2NH3(g)+CO2(g)![]() CO(NH2)2(l)+H2O(g)△H=akJ·mol-1。
CO(NH2)2(l)+H2O(g)△H=akJ·mol-1。
为研究平衡时CO2的转化率与反应物投料比[![]() ]及温度的关系,研究小组在10L恒容密闭容器中进行模拟反应,(Ⅰ、Ⅱ曲线分别表示在不同投料比时,CO2的转化率与温度之间的关系)。
]及温度的关系,研究小组在10L恒容密闭容器中进行模拟反应,(Ⅰ、Ⅱ曲线分别表示在不同投料比时,CO2的转化率与温度之间的关系)。
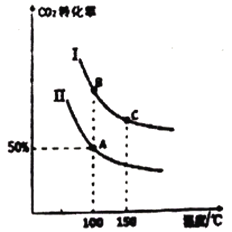
①a_______0(填“>”或“<”)。
②若n(CO2)起始=10mol,曲线Ⅱ的投料比为0.5,在100℃条件下发生反应,达平衡至
③A点平衡常数与B点平衡常数间的关系:KA_______KB;
B点平衡常数与C点平衡常数间的关系,KB_______KC(填“>”或“<”或“=”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有如下所示4个装置图,以下说法中正确的是

A. ①装置可用于比较NaHCO3和Na2CO3的稳定性 B. 用酒精萃取溴水中的溴可选择②装置
C. 如③装置进行实验可看到酸性KMnO4溶液褪色 D. ④装置可用于实验室制取并收集少量SO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某些烃的分子结构模型如图所示。

回答下列问题:
(1) 属于比例模型的是_______(填“甲”、“乙”、“丙”、“丁”或“戊”,下同)。
(2)表示同一种有机化合物的是_______;
(3)存在同分异构体的是_______;写出其同分异构体的结构简式___________;
(4) C10H14属于苯的同系物的所有同分异构体共有_______种。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镍氢电池(NiMH)目前已经成为混合动力汽车的一种主要电池类型,NiMH中的M表示储氢金属或合金,该电池在充电过程中的总反应方程式是Ni(OH)2+M===NiOOH+MH。已知:6NiOOH+NH3+H2O+OH-===6Ni(OH)2+NO![]()
下列说法正确的是( )
A. NiMH电池放电过程中,正极的电极反应式为NiOOH+H2O+e-===Ni(OH)2+OH-
B. 充电过程中OH-从阳极向阴极迁移
C. 充电过程中阴极的电极反应式:H2O+M+e-===MH+OH-,H2O中的H被M还原
D. NiMH电池中可以用KOH溶液、氨水等作为电解质溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是
A. 1L水中溶解了40.0 g NaOH,该溶液的物质的量浓度为1 mol/L
B. 从1L2mol/L的NaCl液中取出0.5L,取出的该溶液的浓度为1mol/L
C. 中和100 mL 1mol/L的H2SO4溶液,需NaOH8.0g
D. 配制500mL0.5mol/L的CuSO4溶液,需40.0g胆矾
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com