
【题目】下列关于物质性质变化的比较,不正确的是( )
A.还原性强弱:F﹣>Cl﹣>I﹣
B.原子半径大小:Na>S>O
C.碱性强弱:KOH>NaOH>LiOH
D.稳定性强弱:HF>HCl>HBr
科目:高中化学 来源: 题型:
【题目】下列离子在溶液中因发生氧化还原反应而不能大量共存的是( )
A.H+、NO3﹣、Fe2+、Na+
B.Ag+、NO3﹣、Cl﹣、K+
C.K+、Ba2+、OH﹣、SO42﹣
D.Cu2+、NH4+、Br﹣、OH﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】正盐A、B均含三种元素,且所含元素种类相同。A在加热条件下发生如下变化。已知,气体D能使带火星的木条复燃。透过蓝色钴玻璃,A、B、C的焰色反应均为紫色。往C的溶液中加入AgNO3溶液,出现白色沉淀,再加入稀硝酸,沉淀不溶解,且沉淀质量为14.35 克。请回答:
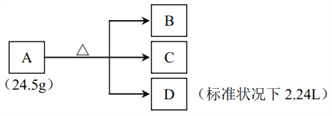
(1)C 的化学式为___________。
(2)写出 A 分解的化学方程式___________。
(3)将A与C混合,再加入稀硫酸,有气体产生,用离子方程式表示发生的反应___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25 ℃时,将1.0L c molL-1CH3COOH溶液与0.1molNaOH固体混合,使之充分反应。然后向该混合溶液中加入少量CH3COOH或CH3COONa固体(忽略体积和温度变化),引起溶液pH的变化如图所示。下列叙述错误的是
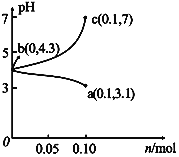
A. 水的电离程度:c>b>a
B. a点对应的混合溶液中,c(CH3COOH)>c(Na+ )>c(OH-)
C. 当混合溶液呈中性时,c(Na+ )=c(CH3COO-)>c(H+) =c(OH-)
D. 该温度下,醋酸的电离平衡常数![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中,反应2NO2(g)![]() N2O4(g),在不同条件下的化学平衡情况如图a、图b所示。图a表示恒温条件下c(NO2)的变化情况,图b表示恒压条件下,平衡体系中N2O4的质量分数随温度变化情况(实线上的任意一点为平衡状态)。下列说法正确的是
N2O4(g),在不同条件下的化学平衡情况如图a、图b所示。图a表示恒温条件下c(NO2)的变化情况,图b表示恒压条件下,平衡体系中N2O4的质量分数随温度变化情况(实线上的任意一点为平衡状态)。下列说法正确的是

图a 图b
A. 图a 中,A1→A2变化的原因一定是充入了NO2
B. 图b中,E点对应状态中,v(正)> v(逆)
C. 图b中,E→A所需的时间为x,D→C所需时间为y,则x < y
D. 依据图b分析可知,该化学反应△H>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)氯化铝水溶液呈______性 ,(填“酸”、“中”、“碱”)性,原因是(用离子方程式表示):_____________________;把AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是_________。
(2)浓度均为0.1 mol/L的①硫酸 ②醋酸 ③氢氧化钠 ④氯化铵四种溶液中由水电离出的H+浓度由大到小的顺序是_________________________(填序号)。
(3)在0.5mol/L的NaHSO3溶液中滴入石蕊,溶液变红,该溶液中HSO3-的电离程度_____HSO3-的水解程度。(填“>”、“=”、“<”)
(4)常温下,将0.2 mol/L CH3COOH和0.1 mol/L NaOH溶液等体积混合,所得溶液的pH<7,该混合溶液中离子浓度由大到小的顺序是______________________________。
(5)相同浓度的下列溶液中,c(CO32-)的大小顺序是_________________(填序号)。
①Na2CO3 ②NaHCO3 ③H2CO3 ④(NH4)2CO3 ⑤NH4HCO3
(6)常温下,用0.01 mol/L HCl溶液完全中和pH=11的下列溶液各100mL,需HCl溶液体积的大小关系是_______________________________(填序号)。
①NaOH ②Ba(OH)2 ③NH3·H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2的大量排放不仅会造成温室效应还会引起海水中富含二氧化碳后酸度增加,可能会杀死一些海洋生物,甚至会溶解掉部分海床,从而造成灾难性的后果。所以二氧化碳的吸收和利用成为当前研究的重要课题。
(1)工业上以CO2与H2为原料合成甲醇,再以甲醇为原料来合成甲醚。
已知:CO2(g)+3H2(g)CH3OH(g)+H2O(g) △H1
2CH3OH(g)CH3OCH3(g)+H2O(g) △H2=-24.5 kJmol﹣1
2CO2(g)+6H2(g) CH3OCH3(g)+3H2O(g) △H3=-122.5 kJmol﹣1
甲醇的电子式为________________;△H1=________kJ·mol-1
(2)某科研小组探究用活性炭处理汽车尾气的可行性,在T1℃体积为2L的恒温密闭容器中进行了实验,并根据实验数据绘制了如下图像,其中X代表NO浓度变化,Y代表N2和CO2浓度变化:
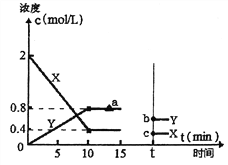
①若15min,后升高到一定温度,达到新平衡后容器中N2、CO2、NO的浓度之比为1:1:3,到达到新平衡时CO2的反应速率与图中a点相比较,速率_____(填“增大”、“减小”或“不变”),此时平衡常数K与T1℃相比_______(填“增大”、“减小”或“不变”)。②T1℃时该反应的平衡常数为_________________。
③如上图所示,若15min后改变了一个条件,t时刻建立新的平衡,b点坐标(0.6,t),c点坐标(0.3,t)。则改变的条件可能是_______(填序号)。
a.扩大容器体积 b.升高温度 c.使用合适催化剂 d.移走部分NO
(3)已知:H2CO3的电离常数Ka1=4.4×10-7,Ka2=5×10-11。25℃时若用1L 1mol· L-1的NaOH溶液吸收CO2,当溶液中c(CO32-):c(H2CO3)=2200,此时该溶液的pH值为________________。
(4)以熔融K2CO3为电解质的甲醚燃料电池,具有能量转化率高,储电量大等特点,则该电池的负极电极反应式为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阅读下面的短文,回答问题。
聚碳酸酯(PC)是一类碳酸的聚酯,是一种强韧的热塑性树脂,耐弱酸,耐弱碱,耐中性油,不耐强碱,有阻燃性。其光学性能接近有机玻璃(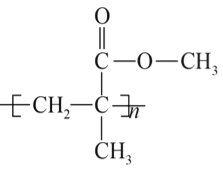 ),在透明建筑板材、电子电器、光盘媒介、汽车工业等领域有广泛应用。碳酸本身并不稳定,但其衍生物,如碳酸二苯酚酯、光气等有一定稳定性。工业上以碳酸的衍生物和双酚A为原料合成聚碳酸酯(PC),反应如下:
),在透明建筑板材、电子电器、光盘媒介、汽车工业等领域有广泛应用。碳酸本身并不稳定,但其衍生物,如碳酸二苯酚酯、光气等有一定稳定性。工业上以碳酸的衍生物和双酚A为原料合成聚碳酸酯(PC),反应如下:
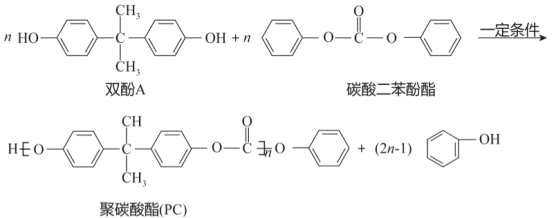
(1)下列说法正确的是_______(填序号)。
a.光气比碳酸稳定
b.聚碳酸酯能和强碱发生反应
c.聚碳酸酯易燃
d.聚碳酸酯是一种强韧的热塑性树脂
(2)双酚A和光气(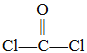 )也可发生类似的缩聚反应,生成一种聚碳酸酯。该反应的化学方程式是___________________________________________________。
)也可发生类似的缩聚反应,生成一种聚碳酸酯。该反应的化学方程式是___________________________________________________。
(3)有机玻璃的单体的结构简式是___________________________________________。在一定条件下,有机玻璃和NaOH溶液能发生反应,该反应的化学方程式是_______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com