

| 1 |
| 2 |
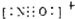 ,故正确;
,故正确;| 1 |
| 2 |
| 1 |
| 4 |
| 1 |
| 8 |


 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
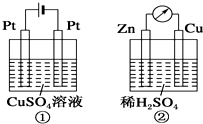 如图所示的两个装置中,溶液的体积 均为200mL,开始时电解质溶液的浓度均为0.1mol/L.工作一段时间后,测得导线中均通过0.02mol电子.若不考虑盐的水解和溶液体积的变化,则下列叙述中正确的是( )
如图所示的两个装置中,溶液的体积 均为200mL,开始时电解质溶液的浓度均为0.1mol/L.工作一段时间后,测得导线中均通过0.02mol电子.若不考虑盐的水解和溶液体积的变化,则下列叙述中正确的是( )| A、产生气体的体积:①>② |
| B、溶液的pH变化:①增大,②减小 |
| C、电极上析出固体物质的质量:①>② |
| D、电极反应式:①的阴极:Cu2++2e-═Cu,②的负极:2H++2e-═H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在熔融电解质中,O2-向负极定向移动 |
| B、电池的总反应是:2C4H10+13O2═8CO2+10H2O |
| C、通入空气的一极是正极,电极反应为:O2+4e-═2O2- |
| D、通入丁烷的一极是负极,电极反应为:C4H10+26e-+13O2-═4CO2↑+5H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
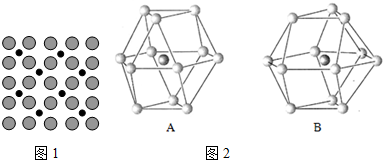
| N |
| Fe |
查看答案和解析>>
科目:高中化学 来源: 题型:
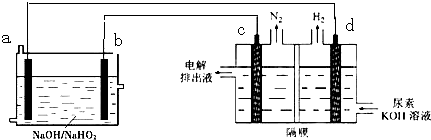
| A、燃料电池总反应为:3HO2-+2Al=OH-+2AlO2-+H2O |
| B、电极b是正极,且反应后该电极区pH增大 |
| C、每消耗27g Al,理论上产生11.2L(标准状况下)氮气 |
| D、反应时,电子的流向为:a→b→c→d. |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CH4+2O2═CO2+2H2O | ||||
| B、2Na+2H2O=2NaOH+H2↑ | ||||
C、2KClO3
| ||||
| D、CaCO3+2HCl=CaCl2+H2O+CO2↑ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com