
(14分)利用废铁丝、硫酸铜废液(含硫酸亚铁)和被有机物污染的废铜粉制备硫酸铜晶体。生产过程如下:

试回答下列问题:
(1)铁丝在投入硫酸铜废液前需用稀H2SO4进行处理,可能发生反应的离子方程式有 。
(2)为了使灼烧后的氧化铜混合物充分酸溶,在加入稀H2SO4的同时,还通入O2。通入O2的目的是(用化学反应方程式表示) 。
在实验室中,常将适量浓硝酸分多次加入到铜粉与稀硫酸的混合物中,加热使之反应完全,通过蒸发、结晶得到硫酸铜晶体(装置如图所示)。
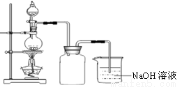
(3)写出烧瓶中发生反应的离子方程式为
(4)广口瓶的作用是
(5)为符合绿色化学的要求,某研究性学习小组进行如下
设计:将3.2 g铜丝放到45 mL 1.5 mol·L-1的稀硫酸中,控温在50 ℃。加入18 mL 10%的H2O2,反应0.5h后,升温到60 ℃,持续反应1 h后,过滤、蒸发浓缩、减压抽滤等,用少量95%的酒精淋洗后晾干,得CuSO4·5H2O 10.5 g。请回答:
①加热时温度不宜过高的原因是 ;
②本实验CuSO4·5H2O的产率为 。
⑴ Fe2O3+6H+=2Fe3++3H2O,2Fe3++Fe=3Fe2+,Fe+2H+=Fe2++H2↑;
⑵ 2Cu+O2+2H2SO4=2CuSO4+2H2O 或2Cu+O2=2CuO,CuO+H2SO4=CuSO4+H2O ;
⑶ 3Cu+8H++3NO3- =3Cu2++2NO↑+4H2O ;
⑷ 安全瓶 ;⑸ ①防止双氧水分解 ;②84% 。
【解析】
试题分析:(1)铁丝表面有铁锈。投入稀H2SO4中发生反应的两种方程式为:Fe2O3+6H+=2Fe3++3H2O;2Fe3++Fe=3Fe2+;Fe+2H+=Fe2++H2↑;(2)为了使灼烧后的氧化铜混合物充分酸溶,在加入稀H2SO4的同时,还通入O2。通入O2的目的是使Cu变为氧化铜,与酸反应得到CuSO4.反应的方程式为:2Cu+O2+2H2SO4=2CuSO4+2H2O 或2Cu+O2=2CuO,CuO+H2SO4=CuSO4+H2O ;(3)在烧瓶中Cu与稀硝酸发生反应的离子方程式为:3Cu+8H++3NO3- =3Cu2++2NO↑+4H2O ;(4)广口瓶的作用是安全瓶,防止倒吸现象的发生;(5)①加热时温度不宜过高是由于在反应的过程中使用了H2O2,而H2O2受热容易分解,使用温度不宜过高。②n(Cu)= 3.2 g÷64g/mol=0.05mol,n(H2SO4)= 0.045 L×1.5 mol/L= 0.0675 mol硫酸过量,所以产生的CuSO4按照Cu来计算,理论产量:0.05mol×250g/mol=12.5g。因此CuSO4·5H2O的产率为(10.5 g÷12.5g)×100%=84%。
考点:考查物质的制取方法、化学方程式、离子方程式的书写、反应条件的选择及物质的产率的计算。


科目:高中化学 来源:2013-2014黑龙江省双鸭山市高二下学期期末考试化学试卷(解析版) 题型:填空题
(8分)往100 mL的NaOH溶液中通入CO2充分反应后,在减压和较低温度下,小心地将溶液蒸干,得到白色固体M。通入的CO2的体积V(标准状况)与M的质量W的关系如下图所示。试解答下列问题:
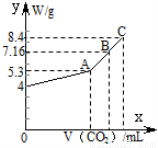
(1)A点时,白色固体M的化学式为____________________,通入的CO2的体积为________ mL (标准状况下,下同)。
(2)C点时,白色固体M的化学式为____________________,通入的CO2的体积为________ mL。
(3)B点时M的组成成分为________(用化学式表示),通入的CO2的体积为________ mL。
(4)该NaOH溶液的物质的量浓度为________。
查看答案和解析>>
科目:高中化学 来源:2013-2014黑龙江省双鸭山市高一下学期期末考试化学试卷(解析版) 题型:选择题
下列各实验,不可能成功的是( )
①蒸馏普通酒精制无水乙醇; ②苯与浓硫酸混合加热至60℃制硝基苯;
③用苯和溴水混合制溴苯; ④用裂化汽油从碘水中提取碘
A.只有①和④ B.只有②和③ C.只有①和③ D.①②③④
查看答案和解析>>
科目:高中化学 来源:2013-2014青海西宁五中片区大联考高三5月高考模拟理综化学试卷(解析版) 题型:实验题
(14分)氯碱厂电解饱和食盐水制取NaOH的工艺流程示意图如下:

依据上图完成下列问题:
在电解过程中,阴极上生成气体的电子式为 。
(2)精制过程中除去阳离子中的Ca2+、Mg2+等杂质,除去Mg2+的离子方程式为 。
(3)精制过程要除去SO42-,可选择下列溶液中的 (填字母序号)
a. Ba(OH)2 b.Ba(NO3)2 c.BaCl2
(4)在实际生产中也可以用BaCO3除去SO42-(已知溶解度BaSO4<BaCO3),试用平衡移动原理加以解释: 。
(5) 脱盐工作中,利用NaOH和NaCl在溶解度上的差异,通过蒸发、冷却、 、 (填操作名称)而制得50%的NaOH溶液。
(6)写出电解饱和食盐水的离子方程式:
查看答案和解析>>
科目:高中化学 来源:2013-2014青海西宁五中片区大联考高三5月高考模拟理综化学试卷(解析版) 题型:选择题
设NA为阿伏伽德罗常数的数值,下列说法正确的是
A.常温下,23g NO2含有NA个氧原子
B.标准状况下,11.2L SO3中含有的分子数为0.5NA
C.1 mol Cl2做氧化剂转移的电子数是NA
D.1L 0.1mol/L-1的氨水中含OH―离子数为0.1NA个
查看答案和解析>>
科目:高中化学 来源:2013-2014陕西西安铁一中、铁一中国际合作校高三四月月考化学试卷(解析版) 题型:选择题
常温下,下列各组离子在指定溶液中一定能大量共存的是
A.加入Mg能放出H2的溶液:Na+、Al3+、Cl-、SO42-
B.常温下,c(H+)/c(OH-)=1010的溶液:Fe2+、K+、NO3-、SO42-
C.加入苯酚显紫色的溶液:NH4+、K+、Cl-、S2-
D.使甲基橙呈红色的溶液:NH4+、Na+、AlO2-、HCO3-
查看答案和解析>>
科目:高中化学 来源:2013-2014陕西西安铁一中、铁一中国际合作校高三五月月考化学试卷(解析版) 题型:填空题
炼金废水中含有络离子[Au(CN)2]+,其电离出的CN—有毒,CN-与H+结合生成HCN时,其毒性更强。回答下列问题:
(1)HCN的电离方程式为______________________NaCN溶液的pH_____7(填“< > =”)
(2)与弱电解质的电离方程式相似,[Au(CN)2]+也存在着两步电离,其一级电离方程式为_________
(3)处理这种废水是在碱性条件下,NaClO将CN—氧化为碳酸根和氮气,其离子方程式为:__________
(4)在酸性条件下,ClO—也能氧化CN--,但实际处理废水时却不在酸性条件下进行的原因是_______________
查看答案和解析>>
科目:高中化学 来源:2013-2014陕西西安铁一中、铁一中国际合作校高三五月月考化学试卷(解析版) 题型:选择题
三氟化氮(NF3)是微电子工业中优良的等离子刻蚀气体,它在潮湿的环境中能发生反应:
3 NF3 + 5 H2O = 2 NO + HNO3 + 9 HF。下列有关该反应的说法正确的是
A.NF3是氧化剂,H2O是还原剂
B.还原剂与氧化剂的物质的量之比为2:1
C.若生成0.2 mol HNO3,则转移0.2 mol电子
D.NF3在潮湿的空气中泄漏会产生红棕色气体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com