
【题目】下列属于有机物的是( )
A.H2CO3B.C2H5OHC.HClOD.NaHCO3
科目:高中化学 来源: 题型:
【题目】电池在现代社会中具有极其广泛的应用。
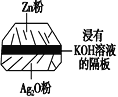
(1)银锌蓄电池(右图)是人造卫星所使用的高能电池之一,其放电时的反应是Zn+Ag2O===ZnO+2Ag。电解质溶液为KOH溶液。则该电池的负极材料是________,放电时正极的电极反应式为________________,放电时负极区的pH________(填“增大”、“减小”或“不变)。
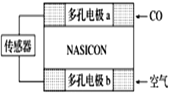
(2)利用原电池工作原理测定汽车尾气中CO的浓度,其装置如下图所示。该电池中O2-可以在固体介质NASICON(固溶体)内自由移动,工作时O2-的移动方向________(填“从a到b”或“从b到a”),负极发生的电极反应式为____________________________________。正极发生的电极反应式为____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的分类合理的是( )
A.氧化物:CO2 , NO,SO2 , H2O
B.碱:NaOH,KOH,Ba(OH)2 , Na2CO3
C.铵盐:NH4Cl,NH4NO3 , (NH4)2SO4 , NH3H2O
D.碱性氧化物:Na2O,CaO,Mn2O7 , Al2O3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组研究溶液中Fe2+的稳定性,进行如下实验,记录结果。
【实验Ⅰ】
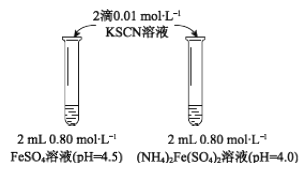
物质 | 0 min | 1min | 1h | 5h |
FeSO4 | 淡黄色 | 桔红色 | 红色 | 深红色 |
((NH4)2Fe(SO4)2 | 几乎无色 | 淡黄色 | 黄色 | 桔红色 |
(1)上述(NH4)2Fe(SO4)2溶液pH小于FeSO4的原因是_____________(用离子方程式表示)。溶液的稳定性:FeSO4_______(NH4)2Fe(SO4)2(填“>”或“<”)。
(2)甲同学提出实验Ⅰ中两溶液的稳定性差异可能是(NH4)2Fe(SO4)2溶液中的NH4+保护了Fe2+,因为NH4+具有还原性。进行【实验Ⅱ】,否定了该观点,请补全该实验。
操作 | 现象 |
取__________,滴加_______,观察。 | 与实验Ⅰ中(NH4)2Fe(SO4)2溶液现象相同。 |
(3)乙同学提出【实验Ⅰ】中两溶液的稳定性差异是溶液酸性不同导致,进行【实验III】,分别配制0.8 mol![]() L—pH为1、2、3、4的FeSO4溶液,观察,发现pH=1的FeSO4溶液长时间无明显变化,pH越大,FeSO4溶液变黄的时间越短。
L—pH为1、2、3、4的FeSO4溶液,观察,发现pH=1的FeSO4溶液长时间无明显变化,pH越大,FeSO4溶液变黄的时间越短。
资料显示:亚铁盐溶液中存在反应4Fe2++O2+10H2O ![]() 4Fe(OH)3+8H+
4Fe(OH)3+8H+
由【实验III】,乙同学可得出实验的结论是___________________________,原因是___________________________________________________________。
(4)进一步研究在水溶液中
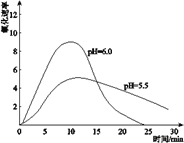
(5)综合以上实验,增强Fe2+稳定性的措施有__________________________。
(6)向溶液中加入一定量H2O2氧化Fe2+。为确定加入H2O2的量,需先用K2Cr2O7标准溶液滴定滤液中的Fe2+,离子方程式如下:Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O。
①在向滴定管注入K2Cr2O7标准溶液前,滴定管需要检漏、用蒸馏水洗涤和_____________________,应选用___________式滴定管。
②若滴定xmL滤液中的Fe2+,消耗amol·L—1K2Cr2O7标准溶液bmL,则滤液中c(Fe2+)=______mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.根据下列各题中所给出的数据,可分别求出其溶液的“溶质质量分数”或溶液的“物质的量浓度”,试判断并求解。
(1)已知某氢氧化钠溶液V L中含有N个氢氧根离子,可求出此溶液的________ 是________。
(2)已知某氢氧化钠溶液中Na+与H2O的个数之比为1∶a,则可求出此溶液的________为________。
Ⅱ.常温下,10.0 mL 1.0 mol·L-1的H2SO4(aq),加水稀释到500 mL,所得H2SO4(aq)的浓度为________mol·L-1;蒸发浓缩,使溶液的体积为2.40 mL,所得H2SO4(aq)的浓度为________mol·L-1。
Ⅲ.已知标准状况下1体积水能溶解500体积的氯化氢,则可求出标准状况下氯化氢饱和溶液中溶质的质量分数为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是模拟“侯氏制碱法”制取NaHCO3的部分装置。下列操作正确的是

A. a先通入CO2,然后b通入NH3,c中放碱石灰
B. a先通入NH3,然后b通入CO2,c中放蘸稀硫酸的脱脂棉
C. b先通入NH3,然后a通入CO2,c中放碱石灰
D. b先通入CO2,然后a通入NH3,c中放蘸稀硫酸的脱脂棉
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素铬(Cr)在溶液中主要以Cr3+(蓝紫色)、Cr(OH)![]() (绿色)、Cr2O72-(橙红色)、CrO42-(黄色)等形式存在。Cr(OH)3为难溶于水的灰蓝色固体。回答下列问题:
(绿色)、Cr2O72-(橙红色)、CrO42-(黄色)等形式存在。Cr(OH)3为难溶于水的灰蓝色固体。回答下列问题:
(1)Cr3+与Al3+的化学性质相似。在Cr2(SO4)3溶液中逐滴加入NaOH溶液直至过量,可观察到的现象是________________________;
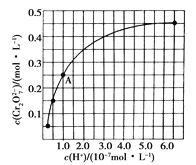
(2)CrO42-和Cr2O72-在溶液中可相互转化。室温下初始浓度为1.0 mol·L-1的Na2CrO4溶液中c(Cr2O72-)随c(H+)的变化如上图所示。
①用离子方程式表示Na2CrO4溶液中的转化反应_____________________;
②由图可知,溶液酸性增大,CrO42-的平衡转化率________(填“增大”“减小”或“不变”)。根据A点数据,计算出该转化反应的平衡常数为___________;
③升高温度,溶液中CrO42-的平衡转化率减小,则该反应的ΔH________0(填“大于”“小于”或“等于”)。
(3)在化学分析中采用K2CrO4为指示剂,以AgNO3标准溶液滴定溶液中Cl-,利用Ag+与CrO42-生成砖红色沉淀,指示滴定终点的到达。当溶液中Cl-恰好沉淀完全(Cl-浓度等于1.0×10-5mol·L-1)时,溶液中c(Ag+)为________mol·L-1,此时溶液中c(CrO![]() )等于________mol·L-1。(已知Ag2CrO4、AgCl的Ksp分别为2.0×10-12和2.0×10-10)。
)等于________mol·L-1。(已知Ag2CrO4、AgCl的Ksp分别为2.0×10-12和2.0×10-10)。
(4)+6价铬的化合物毒性较大,常用NaHSO3将废液中的Cr2O72-还原成Cr3+,该反应的离子方程式为_______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚乙二醇(PEG) 是一种用途广泛的聚合物,1,2-乙二醇碳酸酯(又称为碳酸亚乙酯) 是一种医药中间体。某小组以烃A 为原料合成PEG和碳酸亚乙酯的路线设计如下: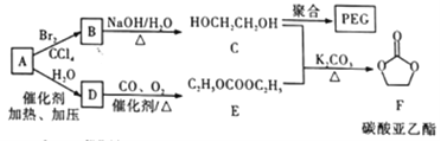
已知: 2C2H5OH+CO+1/2O2 ![]() C2H5OCOOC2H5+H2O
C2H5OCOOC2H5+H2O
回答下列问题:
(1)A的名称为____________; A→B的反应类型为__________;C 的核磁共振氢谱中峰面积比为___________;F的分子式为____________________。
(2)B→C的化学方程式为____________。
(3)C在一定条件下发生聚合反应生成PEC,化学方程式为___________________;若某种PEG的平均相对分子质量为2000, 则其平均聚合度为____________________。
(4)E的同分异构体中,含有—OCOO—基团的共有___种(不包含E和立体异构)。
(5)有人认为C和E生成F的反应历程可能如下:
①HOCH2CH2OH + CO32-![]() HOCH2CH2O-+HCO3-
HOCH2CH2O-+HCO3-
②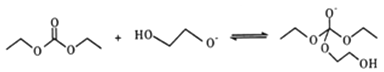
③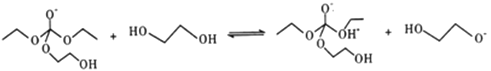
④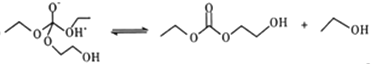
⑤
⑥⑦⑧……
⑨HOCH2CH2O- +HCO3-→HOCH2CH2OH+CO32-
写出上述历程中⑥⑦⑧的反应方程式___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学研究小组探究外界条件对化学反应mA(g)+nB(g)![]() pC(g)的速率和平衡的影响图像如下,下列判断正确的是 ( )
pC(g)的速率和平衡的影响图像如下,下列判断正确的是 ( )
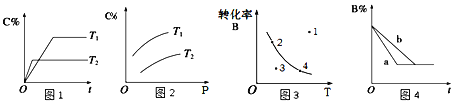
A. 由图1可知,T1<T2,该反应正反应为吸热反应
B. 由图2可知,该反应m+n﹤p
C. 图3中,表示反应速率v正>v逆的是点3
D. 图4中,若m+n=p,则a曲线一定使用了催化剂
【答案】C
【解析】A. 由图1可知,T2时达到平衡所需时间短,所以T1<T2,升温平衡左移,该反应正反应为放热反应,故A错误;B. 由图2可知,加压平衡右移,说明该反应m+n>p,故B错误;C. 图3中,温度一定,点3达到平衡的过程中B减少,V正>V逆,故C正确;D. 图4中,若m+n=p,加压平衡不移动,则a曲线可能为加压,故D错误。故选C。
点睛:在分析本题图1和图4一类涉及影响反应速率条件的图像时,注意把握图像的关键内容—斜线的斜率,斜率越大,反应速率越大,对应的是有利于增大反应速率的条件。
【题型】单选题
【结束】
11
【题目】等物质的量的X(g)与Y(g)在密闭容器中进行反应:X(g)+2Y(g)![]() 3Z(g)+Q(s) △H >0,下列叙述正确的是
3Z(g)+Q(s) △H >0,下列叙述正确的是
A. 当容器中X与Y的物质的量的比满足1:2时反应达到平衡
B. 达到平衡时X的转化率为25%,则平衡常数K值为9/4
C. 达到平衡后,反应速率2V正(Y)="3" V逆(Z)
D. 达到平衡后,加入Q,平衡逆向移动
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com