
| 化学键 | N≡N | H-O | N-H | O=O |
| E/(kJ/mol) | 946 | 463 | 391 | 496 |
| .01mol/L 的溶液 | X | Y | Z | W |
| pH | 12 | 2 | 8.5 | 4.5 |
分析 (1)旧键断裂吸收的能量减去新键生成释放的能量值即为反应热,1molN2含有1molN≡N,1molH2°含有2molH-O,1molNH3含有3molN-H,依据△H=反应物的总键能-生成物的总键能进行计算;
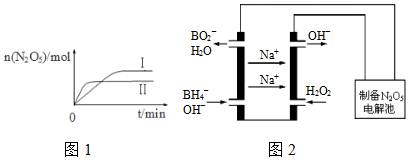
(2)①由图1可知,温度Ⅰ<Ⅱ,再结合温度升高时N2O5的物质量变化,判断温度升高时平衡移动方向,△H-T△S<0时,反应能够自发进行;
②A.扩大容器体积,平衡逆向移动,但各组分浓度都减小;
B.恒温恒容下,再充入2molNO2和1molO2,相当于加压,平衡正向移动;
C.容器体积不变,气体质量不变;
D.正反应放热,降温平衡正向移动;
(3)由图2可知,原电池工作时Na+向正极移动,则原电池的左侧为负极,BH4-在碱性条件发生氧化反应生成BO2-;
(4)X、Y、Z各1mol•L-1同时溶于水中制得混合溶液,溶液中的溶质为等物质的量浓度的硝酸钠和亚硝酸钠,亚硝酸钠能水解而使溶液呈碱性,则c(OH-)>c(H+),钠离子和硝酸根离子都不水解,但盐类水解较微弱,所以离子浓度大小关系是c(Na+)>c(NO3-)>c(NO2-)>c(OH-)>c(H+);
(5)①已知:Ⅰ:2NO2(g)+NaCl(s)?NaNO3(s)+ClNO(g),
Ⅱ:2NO(g)+Cl2(g)?2ClNO(g),
根据盖斯定律Ⅰ×2-Ⅱ可得:4NO2(g)+2NaCl(s)?2NaNO3(s)+2NO(g)+Cl2(g),则该反应平衡常数为①的平衡常数平方与②的商;
②测得10min内v(ClNO)=7.5×10-3mol•L-1•min-1,则△n(ClNO)=7.5×10-3mol•L-1•min-1×10min×2L=0.15mol,由方程式计算参加反应NO、氯气的物质的量,进而计算平衡时氯气的物质的量、NO的转化率;
正反应为气体物质的量减小的反应,恒温恒容下条件下,到达平衡时压强比起始压强小,其他条件保持不变,反应(Ⅱ)在恒压条件下进行,等效为在恒温恒容下的平衡基础上增大压强,平衡正向移动.
解答 解:(1)2N2(g)+6H2O(g)=4NH3(g)+3O2(g),△H=反应物的总键能-生成物的总键能=2×946KJ/mol+12×463KJ/mol-12×391KJ/mol-3×496KJ/mol=+1268KJ/mol,
故答案为:+1268;
(2)①由图1可知,温度Ⅱ>Ⅰ,升高温度时升高时N2O5的物质量减小,说明平衡逆向移动,说明正反应放热;该反应的正反应放热,则逆反应吸热,△H>0,若逆反应能够自发进行,则其,△H-T△S<0,必须要△S>0,故答案为:逆反应方向的△S>0;
②A.扩大容器体积,无论平衡怎样移动,各组分浓度都减小,混合气体颜色变浅,故A错误;
B.与开始加入比例相同加入反应物,平衡正向移动,反应物转化率增大,故B正确;
C.容器中气体密度始终不变,所以密度不变不能说明反应达到平衡状态,故C错误;
D.降温平衡正向移动,化学平衡常数增大,故D正确;
故答案为:BD;
(3)由图2可知,硼氢化钠燃料电池的左侧为负极,BH4-在碱性条件发生氧化反应生成BO2-,电极反应式为:BH4-+8OH--8e-=BO2-+6H2O,故答案为:BH4-+8OH--8e-=BO2-+6H2O;
(4)X、Y、Z各1mol•L-1同时溶于水中制得混合溶液,溶液中的溶质为等物质的量浓度的硝酸钠和亚硝酸钠,亚硝酸钠能水解而使溶液呈碱性,则c(OH-)>c(H+),钠离子和硝酸根离子都不水解,但盐类水解较微弱,所以离子浓度大小关系是c(Na+)>c(NO3-)>c(NO2-)>c(OH-)>c(H+),
故答案为:c(Na+)>c(NO3-)>c(NO2-)>c(OH-)>c(H+);
(5)2NO2(g)+NaCl(s)?NaNO3(s)+ClNO(g) K1 △H<0 (I)
2NO(g)+Cl2(g)?2ClNO(g) K2 △H<0 (II)
根据盖斯定律,Ⅰ×2-Ⅱ可得:4NO2(g)+2NaCl(s)?2NaNO3(s)+2NO(g)+Cl2(g),则该反应平衡常数K=$\frac{{{K}_{1}}^{2}}{{K}_{2}}$,故答案为:$\frac{{{K}_{1}}^{2}}{{K}_{2}}$;
(2)测得10min内v(ClNO)=7.5×10-3mol•L-1•min-1,则△n(ClNO)=7.5×10-3mol•L-1•min-1×10min×2L=0.15mol,
由方程式可知,参加反应氯气的物质的量为0.15mol×$\frac{1}{2}$=0.075mol,故平衡时氯气的物质的量为0.1mol-0.075mol=0.025mol;
参加反应NO物质的量为0.15mol,则NO的转化率为$\frac{0.15mol}{0.2mol}$×100%=75%;
正反应为气体物质的量减小的反应,恒温恒容下条件下,到达平衡时压强比起始压强小,其他条件保持不变,反应(Ⅱ)在恒压条件下进行,等效为在恒温恒容下的平衡基础上增大压强,平衡正向移动,NO转化率增大,故转化率α2>α1;
故答案为:75%;>.
点评 本题侧重化学反应速率、化学平衡常数、平衡影响因素、化学反应热量计算、电化学知识、盐类水解以及离子浓度大小比较的全面考查,题目难度中等,能很好地考查学生的分析能力、化学平衡影响和反应速率影响因素及电化学知识的综合理解和运用,明确离子浓度的比较方法及燃料电池发生的电极反应和化学平衡移动原理是解答本题的关键.


 提分百分百检测卷系列答案
提分百分百检测卷系列答案 宝贝计划期末冲刺夺100分系列答案
宝贝计划期末冲刺夺100分系列答案 能考试全能100分系列答案
能考试全能100分系列答案科目:高中化学 来源: 题型:解答题
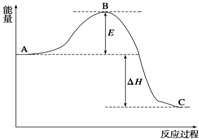 2SO2(g)+O2(g)?2SO3(g),反应过程的能量变化如图
2SO2(g)+O2(g)?2SO3(g),反应过程的能量变化如图查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2O2和CO2反应中,Na2O2既是氧化剂又是还原剂 | |
| B. | Na2O2、Cl2、SO2使品红溶液褪色的原理相同 | |
| C. | 等物质的量的Cl2和SO2同时通入品红溶液中,品红褪色更快 | |
| D. | 在Na2O2中阴阳离子所含的电子数目相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
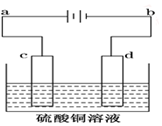 电解装置如图所示:
电解装置如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:实验题
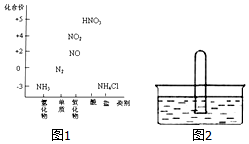 图1为氮及其化合物的类别与化合价对应的关系图.
图1为氮及其化合物的类别与化合价对应的关系图.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol X和0.2 mol Y充分反应生成Z的物质的量一定小于0.3 mol | |
| B. | 达到化学平衡状态时,X、Y、Z的浓度不再发生变化 | |
| C. | 达到化学平衡状态时,反应放出的总热量可达a kJ | |
| D. | 升高反应温度,逆反应速率增大,正反应速率减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 75mL2mol•L-1 CaCl2溶液 | B. | 150mL2mol•L-1NaCl溶液 | ||
| C. | 150mL2mol•L-1KClO3溶液 | D. | 75mL1mol•L-1 AlCl3溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com