
【题目】工业中很多重要的化工原料都来源于石油化工,如图中的苯、丙烯、有机物A等,其中A的年产量可以用来衡量一个国家的石油化工发展水平。请回答下列问题:

(1)A的结构简式为_______,丙烯酸中含氧官能团的名称为______;
(2)写出下列反应的反应类型①________,④________;
(3)下列说法正确的是:________;
A.为除去硝基苯中混有的浓HNO3和H2SO4,可将其倒入到NaOH溶液中,静置,分液
B.除去乙酸乙酯中的乙酸,加NaOH溶液、分液
C.有机物C与丙烯酸属于同系物
(4)写出④的反应方程式:__________。
【答案】CH2=CH2 羧基 硝化反应或取代反应 取代(或酯化)反应 A CH2=CHCOOH + CH3CH2OH![]() CH2=CHCOOCH2CH3+ H2O
CH2=CHCOOCH2CH3+ H2O
【解析】
A的产量可以用来衡量一个国家的石油化工发展水平,A应为CH2=CH2,乙烯与水发生加成反应生成乙醇,乙醇被催化氧化生成乙醛,乙醛进一步被氧化生成乙酸;乙醇和乙酸发生酯化反应生成乙酸乙酯。结合有机物的结构特点及反应类型进行判断分析。
(1)A为乙烯,其结构简式为CH2=CH2;丙烯酸中含氧官能团的名称为羧基;
(2)反应①是苯在浓硫酸催化下与浓硝酸发生硝化反应生成硝基苯和水,反应类型为硝化反应或取代反应;
反应④是乙醇和丙烯酸的酯化反应,反应类型为取代(或酯化)反应;
(3)A.浓HNO3和H2SO4与NaOH溶液反应,形成水层,硝基苯为有机层,静置,分液,选项A正确;
B.乙酸乙酯与氢氧化钠能反应,除去乙酸乙酯中的乙酸,应该用饱和碳酸钠溶液,选项B错误;
C.C是乙酸为饱和酸,丙烯酸为不饱和酸,两者结构不同,不是同系物,选项C错误;
综上所述答案为A;
(4)反应④是乙醇和丙烯酸的酯化反应,反应方程式为CH2=CHCOOH+CH3CH2OH![]() CH2=CHCOOCH2CH3+H2O。
CH2=CHCOOCH2CH3+H2O。


 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案科目:高中化学 来源: 题型:
【题目】研究非元素及其化合物的性质具有重要意义。含硫物质燃烧会产生大量烟气,主要成分是SO2、CO2、N2、O2 。某研究性学习小组在实验室利用下列装置制备模拟烟气,并测定烟气中SO2的体积分数。

(一)模拟烟气的制备
(1)用A装置制SO2,化学反应方程式为___________________________。
(2)用B装置制CO2,使用该装置优点的是___________________________。
(3)将制得的气体与空气充分混合,获得模拟烟气用于后续实验。
(二)测定烟气中SO2的体积分数
(4)将部分模拟烟气缓慢通过C、D装置,其中C、D中盛有的药品分别是______、__________。(填序号)
①KMnO4溶液 ②饱和NaHSO3溶液 ③饱和Na2CO3溶液 ④饱和NaHCO3溶液
(5)若模拟烟气的流速为amL/min,若t1分钟后,测得量筒内液体体积为VmL,则SO2的体积分数____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在1 L 1 mol·L-1的氨水中,下列说法正确的是( )
A.含1 mol NH3·H2OB.含1 mol![]() 和OH-
和OH-
C.含![]() 和NH3·H2O的和为1 molD.含NH3、NH3·H2O、
和NH3·H2O的和为1 molD.含NH3、NH3·H2O、![]() 之和为1 mol
之和为1 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如图装置进行实验,将液体A逐滴加入到固体B中,下列叙述正确的是
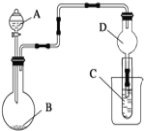
A. 若A为浓H2SO4,B为Na2SO3,C中盛有Na2SiO3溶液,C中溶液出现白色沉淀,证明非金属性S>Si
B. 若A为浓盐酸,B为MnO2,C中盛有KI淀粉溶液,C中溶液变蓝色
C. 若A为浓氨水,B为生石灰,C中盛有AlCl3溶液,C中先产生白色沉淀后沉淀又溶解
D. 若A为H2O2,B为MnO2,C中盛有Na2S溶液,C中溶液变浑浊
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积一定的密闭容器中,置入一定量的NO(g)和足量C(s),发生反应C(s)+2NO(g) ![]() CO2(g)+N2(g),平衡状态时NO(g)的物质的量浓度[NO]与温度T的关系如图所示。则下列说法中正确的是( )
CO2(g)+N2(g),平衡状态时NO(g)的物质的量浓度[NO]与温度T的关系如图所示。则下列说法中正确的是( )

A. 该反应的ΔH>0
B. 若该反应在T1、T2时的平衡常数分别为K1、K2,则K1<K2
C. 在T2时,若反应体系处于状态D,则此时一定有v正<v逆
D. 在T3时,若混合气体的密度不再变化,则可以判断反应达到平衡状态C
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家预测第114号元素具有良好的力学、光学、电学等性质。下列对114号元素的叙述错误的是( )
A.该元素的位于第7周期第Ⅳ![]() 族,是金属元素
族,是金属元素
B.该元素的主要化合价为+2、+4
C.该元素的最高价氧化物有较强的氧化性
D.该元素的原子半径小于同主族其他元素的原子半径
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在三个体积均为0.5 L的恒容密闭容器中发生反应:CO(g)+Cl2(g)![]() COCl2(g),其中容器Ⅰ中反应在5 min时达到平衡状态。
COCl2(g),其中容器Ⅰ中反应在5 min时达到平衡状态。
容器编号 | 温度/℃ | 起始物质的量/mol | 平衡物质的量/mol | ||
CO | Cl2 | COCl2 | COCl2 | ||
Ⅰ | 500 | 1.0 | 1.0 | 0 | 0.8 |
Ⅱ | 500 | 1.0 | a | 0 | 0.5 |
Ⅲ | 600 | 0.5 | 0.5 | 0.5 | 0.7 |
下列说法中正确的是
A. 容器Ⅰ中前5 min的平均反应速率v(CO)=0.16 mol·L-1·min-1
B. 该反应正反应为吸热反应
C. 容器Ⅱ中起始时Cl2的物质的量为0.55 mol
D. 若起始时向容器Ⅰ加入CO0.8mol、Cl20.8mol,达到平衡时CO转化率大于80%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以磷石膏(主要成分是CaSO4,含少量的Al2O3、SiO2等杂质)为原料制备Na2SO4、CaBr2·2H2O和NH4Cl等产品的工艺流程如下:
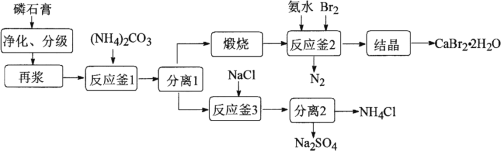
请回答:
(1) 反应釜1中![]() 的浸出率与加料速度、反应温度的关系如下图所示:
的浸出率与加料速度、反应温度的关系如下图所示:
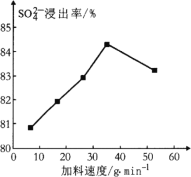

①反应的最佳条件为________。
②其它条件相同时,![]() 浸出率随反应温度先升后降的原因是________。
浸出率随反应温度先升后降的原因是________。
(2) 实验室里模拟上述煅烧操作,下列仪器中有用到的是________。
A 瓷坩埚 B 铁坩埚
C 酒精灯 D 酒精喷灯
(3) 反应釜2中进行的反应是________。
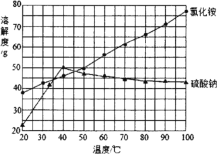
(4) 反应釜3中完成反应后,分离硫酸钠、氯化铵的操作:在90℃左右蒸发浓缩至较多晶体析出→________得到Na2SO4粗品;同时,将热滤液________→得NH4Cl粗品(Na2SO4、NH4Cl的溶解度如图所示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年诺贝尔化学奖授予在锂电池发展上做出贡献的三位科学家。某可连续工作的液流锂离子储能电池放电时工作原理如图所示,下列说法正确的是
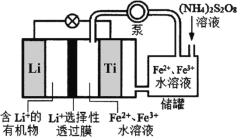
A.放电时,储罐中发生反应:S2O82-+2Fe2+=2Fe3++2SO42-
B.放电时,Li电极发生了还原反应
C.放电时,Ti电极发生的电极方程式为:Fe2+-e=Fe3+
D.Li+选择性透过膜可以通过Li+和H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com