
【题目】某化学研究性学习小组探究与铜有关的物质的性质,过程设计如下:
(提出猜想)
问题1:在周期表中,铜与铝的位置很接近,氢氧化铝具有两性,氢氧化铜有两性码?
问题2:铁和铜都有变价,一般情况下,Fe2+的稳定性小于的Fe3+,Cu+的稳定性也小于Cu2+吗?
问题3:硫酸铜溶液呈蓝色,铜与浓硝酸常温下反应生成的溶液也是蓝色吗?
(实验探究)
I. 解决问题1:
(1)实验需配制100mL 0.50mol·L-1 CuSO4溶液,除了天平、烧杯、玻璃棒、胶头滴管以外必需的玻璃仪器是______。
(2)为达到目的,某同学认为只要进行两次实验即可得出结论。请写出实验②的具体内容。
①向盛有CuSO4溶液的试管中滴加NaOH溶液至过量,观察生成的Cu(OH)2沉淀是否溶解;
②_______。
II. 解决问题2的实验步骤和现象如下:
①取一定量制得的氢氧化铜固体,于坩埚中灼烧,当温度达到80C~100C得到黑色固体粉末;继续加热至1000C以上,黑色粉末全部变成红色粉末氧化亚铜(Cu2O);
②取适量红色氧化亚铜粉末于洁净试管中,加入过量的稀硫酸,得到蓝色溶液,同时观察到试管底部还有红色固体存在。根据以上实验及现象:
(3)写出氧化亚铜与稀硫酸反应的离子方程式____________________________。
(4)从实验中可得出的结论是:当温度在1000C以上时________(填:Cu2+或Cu+,下同)稳定,在酸性溶液中________稳定。
III. 解决问题3,某同学设计的实验如下:取一铜片装入试管,加入适量的浓硝酸,观察溶液的颜色变化。
(5)另一同学认为此同学设计的实验有缺陷,原因是__________________________。
(6)铜与浓硝酸反应溶液呈绿色,有同学认为这是生成的NO2溶于其中的原因,并试图设计实验排除这种干扰。提出实验方案:向反应后的溶液中通入足量空气。试用化学反应方程式解释其原理:___________________________
【答案】100mL容量瓶 另取实验①中所得沉淀,滴加稀硫酸(或稀盐酸等)至过量,观察沉淀是否溶解 Cu2O + 2H+ =Cu + Cu2+ + H2O Cu+ Cu2+ 产生NO2气体,污染环境 4NO2+O2+2H2O=4HNO3
【解析】
(1)实验需配制100mL 0.50mol·L-1 CuSO4溶液,除了天平、烧杯、玻璃棒、胶头滴管以外必需有100mL容量瓶。答案:100mL容量瓶。
(2)要探究氢氧化铜是否具有两性,就要验证Cu(OH)2能否与强酸、强碱溶液反应。向CuSO4溶液加入的NaOH溶液,产生蓝色絮状沉淀。用试管取一定量的沉淀,继续滴加过量的NaOH溶液,观察生成的Cu(OH)2是否溶解;另取上述所得沉淀于试管中,滴加稀硫酸(或稀盐酸等)至过量,观察沉淀是否溶解。答案:另取实验所得沉淀,滴加稀硫酸(或稀盐酸等)至过量,观察沉淀是否溶解。
Ⅱ.(3)取适量红色氧化亚铜粉末于洁净试管中,加入过量的稀硫酸,得到蓝色溶液,同时观察到试管底部还有红色固体存在,说明氧化亚铜在酸性条件下发生歧化反应,生成单质铜和二价铜离子的盐溶液,离子方程式为:Cu2O + 2H+ =Cu + Cu2+ + H2O 。答案:Cu2O + 2H+ =Cu + Cu2+ + H2O。
(4)从实验中可得出的结论是:80C~100C 时,Cu2+稳定,1000C 以上Cu+稳定;在酸性环境Cu2+稳定,Cu+不稳定。答案:Cu+;Cu2+。
Ⅲ.(5)铜片装入试管,加入适量的浓硝酸,反应生成硝酸铜、水和二氧化氮气体,NO2有毒,不能排放到空气中,所以该同学设计的实验有缺陷。答案;产生NO2气体,污染环境。
(6)因为①3NO2+H2O=NO+2HNO3 ,②2NO+O2=2NO2, ①![]() 2+②: 4NO2+O2+2H2O=4HNO3,所以向反应后的溶液中通入足量空气,可以使NO2充分反应生成硝酸,减少干扰。答案:4NO2+O2+2H2O=4HNO3。
2+②: 4NO2+O2+2H2O=4HNO3,所以向反应后的溶液中通入足量空气,可以使NO2充分反应生成硝酸,减少干扰。答案:4NO2+O2+2H2O=4HNO3。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】一只量程为25 mL的滴定管,若液面在8.0 mL处,将溶液全部放下来,液体的体积为( )
A.17.00 mLB.大于17.00 mLC.小于17.00 mLD.无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作能达到实验目的的是
A. 将饱和FeCl3溶液逐滴加到沸水中继续煮沸至液体呈红褐色,可制备Fe(OH)3胶体
B. 电解熔融的氯化铝,可制备铝单质
C. 加热使I2升华,可除去铁粉中的I2
D. 加入足量氨水,充分振荡、过滤,可除去硫酸铜溶液中的硫酸铝杂质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸钾(K2FeO4)是一新型、高效、无毒的多功能水处理剂。制备K2FeO4如下图:查阅资料:K2FeO4为紫色固体,微溶于KOH溶液,具有强氧化性,在酸性或中性溶液中快速产生O2,在碱性溶液中较稳定。
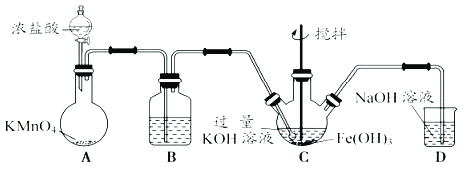
(1)A为制取氯气发生装置,其中盛放浓盐酸的仪器名称为______,A中化学反应的还原剂是______。
(2)装置B的作用是除杂,所用试剂为___________。
(3)C为制备K2FeO4装置,KOH溶液过量的原因是_________________________。
(4)D为尾气处理装置,发生反应的离子方程式为___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水合肼(N2H4·H2O)是无色、有强还原性的液体,实验室制备水合肼的原理为:CO(NH2)2+2NaOH+ NaClO=Na2CO3+N2H4·H2O+NaCl。据此,某学生设计了下列实验。
I、制备 NaClO溶液
实验装置如下图图甲所示(部分夹持装置已省略)
已知:3NaClO![]() 2NaCl+NaClO3
2NaCl+NaClO3
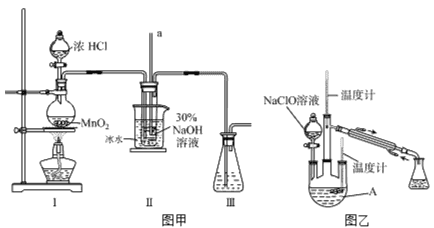
(1)配制30%NaOH溶液时,所需玻璃仪器除量筒外还有______________(填字母)。
A.容量瓶 B.烧杯 C.移液管 D.玻璃棒
(2)装置I中发生的离子反应方程式是_____________________________。
Ⅱ、制取水合肼
实验装置如上图图乙所示
(3)反应过程中,如果分液漏斗中溶液的滴速过快,部分N2H4·H2O参与A中反应并产生大量氮气,产品产率因此降低,请写出降低产率的相关化学反应方程式________________________________;充分反应后,加热蒸馏A内的溶液即可得到水合肼的粗产品。
(4)称取馏分0.3000g,加水配成20.0mL溶液,一定条件下用0.1500mol·L-1的I2溶液滴定。
已知:N2H4·H2O +2I2=N2↑+4HI+H2O
①滴定时,可以选用的指示剂为____________________;
②实验测得消耗I2溶液的平均值为20.00L,馏分中N2H4·H2O的质量分数为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以葡萄糖为原料制得的山梨醇(A)和异山梨醇(B)都是重要的生物质转化平台化合物。E是一种治疗心绞痛的药物,由葡萄糖为原料合成E的过程如下:

回答下列问题:
(1)葡萄糖的实验式为_________________________________。
(2)E中含有的官能团为羟基、醚键和__________________________。
(3)由B到C的反应类型为_____________________。
(4)C的结构简式为_____________________。
(5)由D到E的反应方程式为____________________________________。
(6)F是B的同分异构体,7.30g的F与足量饱碳酸氢钠反应可释放出2.24L二氧化碳(标准状况),F的可能结构共有__________种(不考虑立体异构),其中核磁共振氢谱为三组峰,峰面积比为3:1:1的结构简式为_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学用下图所示装置制备并检验Cl2的性质。下列说法正确的是 ( )

A.Ⅰ图中:如果MnO2过量,浓盐酸就可全部消耗
B.Ⅱ图中:充分光照后,量筒中剩余气体约10 mL(条件相同)
C.Ⅲ图中:生成蓝色的烟,若在集气瓶中加入少量水,溶液呈绿色
D.Ⅳ图中:干燥的有色布条不褪色,湿润的有色布条能褪色,说明Cl2有漂白性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是
A. NO2、SO2、BF3、NCl3分子中没有一个分子中原子的最外层电子都满足了8e-稳定结构;
B. P4和CH4都是正四面体分子且键角都为109o28ˊ;
C. CO2、SO2都是直线形的分子
D. CH2=CH2分子中共有五个σ键和一个π键
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com