
分析 NaHSO4是强电解质,在溶液中能完全电离为钠离子、氢离子和硫酸根离子;pH=5的NaHSO4溶液中,水的电离c(H+)=10-9mol/L,pH=9的NH3•H2O中水的电离c(H+)=10-9mol/L;据此分析.
解答 解:NaHSO4是强电解质,在溶液中能完全电离为钠离子、氢离子和硫酸根离子,故电离方程式为NaHSO4=Na++H++SO42-;
pH=5的NaHSO4溶液中,水的电离c(H+)=10-9mol/L,pH=9的NH3•H2O中水的电离c(H+)=10-9mol/L,则两溶液中水的电离程度相等.
故答案为:NaHSO4=Na++H++SO42-;=.
点评 本题考查了电离方程式的书写和酸碱盐的电离程度的影响,题目难度不大,充分考查了学生灵活应用基础知识的能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 用试管取出试剂瓶中的Na2CO3溶液,发现取量过多,为了不浪费,又把过量的试剂倒入试剂瓶中 | |
| B. | Ba(NO3)2溶于水,可将含有Ba(NO3)2的废液倒入水槽中,再用水冲入下水道 | |
| C. | 用浓硫酸配制一定物质的量浓度的稀硫酸时,浓硫酸溶于水后,应冷却至室温才能转移到容量瓶中 | |
| D. | 用蒸发方法使NaCl从溶液中析出时,应将蒸发皿中NaCl溶液全部加热蒸干 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定是2L K2SO4溶液和1L Al2(SO4)3溶液混合,再加1L蒸馏水 | |
| B. | 三种液体体积比为V1:V2:V3=2:1:1 | |
| C. | 混合液中K+浓度与Al3+浓度数值之和大于SO42-浓度数值 | |
| D. | 混合液中K2SO4 物质的量等于Al2(SO4)3物质的量的一半 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 制取蒸馏水 | B. | 配置500 mL 0.5 mol/L NaCl溶液 | ||
| C. | 除去CaCO3中混有的少量NaCl | D. | 分离食盐水和CCl4的混合液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 提出问题 | B. | 获得结论 | C. | 猜想 | D. | 反思 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
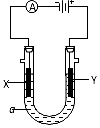 电解原理在化学工业中有广泛的应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
电解原理在化学工业中有广泛的应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com