
| A. | Cl- | B. | Cl2 | C. | H+ | D. | Cu2+ |
科目:高中化学 来源: 题型:解答题

| 溶液中被沉淀的离子 | Fe3+ | Fe2+ | Cu2+ |
| 完全生成氢氧化物的沉淀时,溶液的pH | ≥3.7 | ≥6.4 | ≥4.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
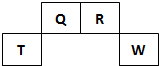 短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等.请回答下列问题:
短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等.请回答下列问题: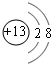 ;
;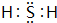 ,原子序数比W多1的元素其单质能使W的氢化物水溶液变浑浊,写出反应的化学方程式Cl2+H2S=S↓+2HCl;
,原子序数比W多1的元素其单质能使W的氢化物水溶液变浑浊,写出反应的化学方程式Cl2+H2S=S↓+2HCl;查看答案和解析>>
科目:高中化学 来源: 题型:填空题
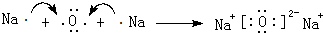 ;C、D还可形成化合物D2C2,D2C2含有的化学键类型是离子键、非极性共价键(或离子键、共价键).
;C、D还可形成化合物D2C2,D2C2含有的化学键类型是离子键、非极性共价键(或离子键、共价键).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2CO3?2H++CO32- | B. | CH3COOH=CH3COO+H+ | ||
| C. | FeCl3=Fe3++3Cl- | D. | NaHCO3=Na++H++CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Zn(s)+CuSO4(aq)═ZnSO4(aq)+Cu(s)△H=-216 kJ•mol-1,则反应物总能量>生成物总能量 | |
| B. | 相同条件下,如果1 mol氢原子所具有的能量为E1,1 mol 氢分子所具有的能量为E2,则2E1=E2 | |
| C. | 25℃、101 kPa时,2H2(g)+O2(g)═2H2O(l)△H=-571.6 kJ•mol-1,则H2的燃烧热为571.6 kJ•mol-1 | |
| D. | H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ•mol-1,则1 mol NaOH的氢氧化钠固体与含0.5 mol H2SO4的稀硫酸混合后放出57.3 kJ的热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同位素:${\;}_{\;}^{1}$H2O、${\;}_{\;}^{2}$H2O、${\;}_{\;}^{3}$H2O | |
| B. | 同系物:CH4、C2H6、C8H18 | |
| C. | 同素异形体:H2、D2、T2 | |
| D. | 胶体:饱和氯化铁溶液、淀粉溶液、牛奶 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 22.4L | B. | 2.24L | C. | 44.8L | D. | 22.45L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com