


 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案科目:高中化学 来源: 题型:
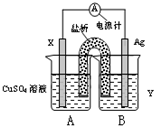 化学科学的重要责任在于认识自然界里存在的各种各样的、奇妙的化学反应,探索纷繁的化学反应的本质和规律.通过化学反应原理模块的学习,我们可以比较深刻地理解化学科学的精髓,提高化学学科素养.请根据所学化学反应原理,解决以下问题.
化学科学的重要责任在于认识自然界里存在的各种各样的、奇妙的化学反应,探索纷繁的化学反应的本质和规律.通过化学反应原理模块的学习,我们可以比较深刻地理解化学科学的精髓,提高化学学科素养.请根据所学化学反应原理,解决以下问题.| 1 |
| 2 |
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源:2012-2013学年福建省宁德市高三5月质检理综化学试卷(解析版) 题型:填空题
铜锢稼硒(CIGS )等化合物薄膜太阳能电池是第三代太阳能电池之一。完成下列填空:
(1)亚铜离子(Cu+)基态时的电子排布式为 。
(2)砷、硒、溴为第4周期相邻元素,其中电负性最大的是 (填元素符号,下同);第一电离能最小的是 。
(3)硼、铝与镓处于同一主族。
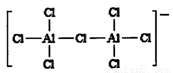
① AlC13在NaCl、KCl融烙盐中能形成A12C17-其结构如图所示。其中A1 原子的杂化轨道类型为 ,配位键数目为 。
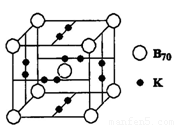
②B元素可形成B70单质,它与金属钾掺杂在一起的化合物,其晶胞如图所示(白球位于立方体的体心和顶点,小黑球位于立方体的面上),则该化合物中B70与钾原子个数比为 ,该化合物中的化学键类型有 。
A.离子键 B.极性键 C.非极性键 D.配位键
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com