
| A. | 过氧化钠是氧化剂,水是还原剂 | B. | Na2O2是还原剂,水是氧化剂 | ||
| C. | 过氧化钠既是氧化剂又是还原剂 | D. | 水既是氧化剂又是还原剂 |
科目:高中化学 来源: 题型:选择题
| 实验目的 | 实验步骤 | |
| A | 比较CH3COOH和H2CO3酸性强弱 | 测同浓度的Na2CO3、CH3COONa溶液的pH |
| B | 比较S和Si非金属性强弱 | 向Na2SiO3溶液中通入SO2出现浑浊 |
| C | 除去KNO3中少量NaCl | 将混合物制成热的饱和溶液,冷却结晶、过滤 |
| D | 探究蔗糖水解产物中是否含有葡萄糖 | 取少量水解液加入新制的氢氧化铜悬浊液并加热 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化合物的名称为2-甲基-5-乙基己烷 | |
| B. | 淀粉、纤维素、蛋白质、油脂都是高分子化合物,一定条件下都能发生水解反应 | |
| C. | 在蛋白质溶液中加入硫酸铜溶液和福尔马林,均能使蛋白质变性,失去生理功能 | |
| D. | CH3COOCH2CH3与CH3CH2CH2COOH互为同分异构体,乙醛和苯甲醛互为同系物 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

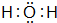 D 的原子结构示意图
D 的原子结构示意图 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 达到化学平衡后,增加A的量有利于化学平衡向正反应方向移动 | |
| B. | 达到平衡后,若使温度升高,化学平衡向逆反应方向移动 | |
| C. | 化学方程式中n<c+f | |
| D. | 达到平衡后,若使用催化剂,C的体积分数不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 向FeI2溶液中不断通入Cl2,溶液中I-、I2、IO3-、Fe2+、Fe3+等粒子物质的量随n(Cl2)/n(FeI2)(即Cl2与FeI2的物质的量之比)的变化可用如图简单表示(“-”表示铁各种价态的变化,用“-•-”表示碘各种形态的变化).下列结论错误的是( )
向FeI2溶液中不断通入Cl2,溶液中I-、I2、IO3-、Fe2+、Fe3+等粒子物质的量随n(Cl2)/n(FeI2)(即Cl2与FeI2的物质的量之比)的变化可用如图简单表示(“-”表示铁各种价态的变化,用“-•-”表示碘各种形态的变化).下列结论错误的是( )| A. | Cl2、I2、IO3-、Fe3+的氧化性依次减小 | |
| B. | 当$\frac{n(C{l}_{2})}{n(Fe{I}_{2})}$=1.2时,反应的离子方程式为2Fe2++10I-+6Cl2═5I2+2Fe3++12Cl- | |
| C. | 当$\frac{n(C{l}_{2})}{n(Fe{I}_{2})}$=6.5时,溶液中$\frac{n(C{l}^{-})}{n(I{O}_{3}^{-})}$=6.5 | |
| D. | 若溶液的体积不变,则溶液的pH减小 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com