
| A. | 改变条件,反应物的转化率增大,平衡常数也一定增大 | |
| B. | 常温下,V1L pH=12的NaOH溶液与V2L pH=2的HA溶液混合,若混合液显中性,则V1≤V2 | |
| C. | 在0.1mol•L-1 NaHCO3溶液中,加入少量NaOH固体,Na+和CO32-的离子浓度均增大 | |
| D. | 原子晶体与分子晶体在溶于水和熔化时化学键均断裂 |
分析 A.平衡常数只受温度影响,温度不变,平衡常数不变;
B.如HA为强酸,则V1=V2,如HA为弱酸,HA的浓度较大;
C.碳酸氢钠和氢氧化钠反应生成碳酸钠;
D.原子晶体不溶于水,分子晶体熔化时破坏分子间作用力.
解答 解:A.平衡常数只与温度有关,温度不变,平衡常数不变,转化率增大,不一定是改变温度使平衡向正反应移动,故转化率增大,平衡常数不一定增大,故A错误;
B.如HA为强酸,则V1=V2,如HA为弱酸,HA的浓度较大,则V1>V2,故B错误;
C.碳酸氢钠和氢氧化钠反应生成碳酸钠,NaHCO3+NaOH=Na2CO3+H2O,Na+和CO32-的离子浓度均增大,故C正确;
D.原子晶体不溶于水,分子晶体熔化时破坏分子间作用力,化学键不断裂,故D错误.
故选C.
点评 本题考查了弱电解质的电离、盐类的水解以及平衡影响因素的分析、酸碱反应后溶液酸碱性判断等知识点,注意平衡常数随温度变化,题目难度中等.


 名校提分一卷通系列答案
名校提分一卷通系列答案 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案 新卷王期末冲刺100分系列答案
新卷王期末冲刺100分系列答案 全能闯关100分系列答案
全能闯关100分系列答案科目:高中化学 来源: 题型:选择题
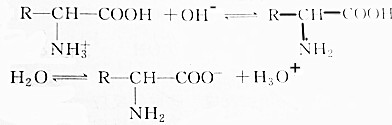
| A. | 增大溶液的pH,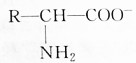 浓度减小 浓度减小 | |
| B. | 降低溶液的pH,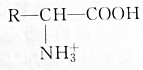 浓度减小 浓度减小 | |
| C. | 如溶液的pH适当,两种氨基酸离子的浓度可能相同 | |
| D. | pH改变,对电离方式无影响 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 把aL0.1mol/L的CH3COOH溶液与bL0.1mol/L的KOH溶液混合,所得溶液中一定存在:c(K+)+c(H+)═c(CH3COO-)+c(OH-) | |
| B. | 把0.1mol/L的NaHCO3溶液与0.3mol/L的Ba(OH)2溶液等体积混合,所得溶液中一定存在:c(OH-)>c(Ba+)>c(Na+)>c(H+) | |
| C. | 向1mol/L的CH3COOH溶液中加入少量CH3COONa固体,由于CH3COONa水解显碱性,所以溶液的pH升高 | |
| D. | 常温下,在pH=3的CH3COOH溶液和pH=11的NaOH溶液中,水的电离程度相同. |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
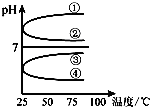 ABCDE五种溶液分别是NaOH溶液、氨水、醋酸、盐酸、NH4HSO4溶液的一种.常温下进行下列实验:
ABCDE五种溶液分别是NaOH溶液、氨水、醋酸、盐酸、NH4HSO4溶液的一种.常温下进行下列实验:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 生成的正盐化学式为BmAn | |
| B. | 该盐中存在着一定水解的离子,该离子水解方程式为:Bm++mH2O?B(OH)m+mH+ | |
| C. | 生成的盐为强酸弱碱盐 | |
| D. | HnA为弱酸,其第一步电离方程式为:HmA?Hm-1A-+H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
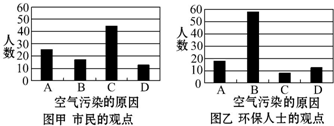
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3Br | B. | CH3CH2CH2CH2Br | ||
| C. | CH3CHBrCH2Br | D. | BrCH2CH2CH2CH2Br |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原电池中失去电子的电极为阳极 | |
| B. | 原电池的两极一定是由活动性不同的两种金属组成 | |
| C. | 电解时电解池的阳极一定是阴离子放电 | |
| D. | 原电池的负极、电解池的阳极都发生氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①⑤ | B. | ②③④⑥⑦ | C. | ①②③④ | D. | 全部 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com