
A、25℃时,若0.1mol/L氨水溶液中
| ||
B、25℃时,将0.1mol/L醋酸溶液加水稀释,保持温度不变,稀释过程中
| ||
| C、0.1mol/L的Na2CO3溶液中:c(OH-)-c(H+)=c(HCO3-)+2c(H2CO3) | ||
| D、浓度均为0.1mol/L的氨水溶液和NH4Cl溶液等体积混合后,若溶液呈碱性,则所得溶液中:c(NH4+)>c(NH3?H2O)>c(Cl-)>c(OH-)>c(H+) |
| c(H+) |
| c(OH-) |
| c(H+) |
| c(OH-) |
| c(H+) |
| c(CH3COOH) |


 名师点拨卷系列答案
名师点拨卷系列答案 英才计划期末调研系列答案
英才计划期末调研系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、热稳定性 |
| B、常温时的溶解度 |
| C、常温时同浓度的pH |
| D、与含1mol HCl的盐酸完全反应时所需的物质的量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、一定条件下,1mol N2和3mol H2充分反应,生成物中的N-H键数目为6NA |
| B、1L 0.1mol?L-1的Na2S的溶液中S2-与HS-的总数为0.1NA |
| C、向含有FeI2的溶液中通入适量氯气,当有1mol Fe2+被氧化时,该反应转移电子的数目至少为3NA |
| D、1L 0.5mol?L-1 (NH4)2SO4溶液中NH4+数目为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、除③外 | B、除②外 |
| C、除②③⑤外 | D、除②⑤外 |
查看答案和解析>>
科目:高中化学 来源: 题型:
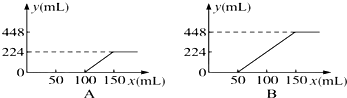
| A、在A情况下,溶质是NaOH和Na2CO3的混合物,其物质的量之比为2:1 |
| B、在B情况下,溶质是Na2CO3和NaHCO3的混合物,其物质的量之比为1:2 |
| C、在B情况下,溶质只有Na2CO3 |
| D、原NaOH溶液的物质的量浓度为1.5 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CO2和CH4都是造成温室效应的气体 |
| B、石油裂解、煤的气化、海水制镁等过程中都包含化学变化 |
| C、铝合金的大量使用归功于人们能使用焦炭等还原剂从氧化铝中获得铝 |
| D、海水中含有钾、钠元素,只需经过物理变化就可以得到钾和钠单质 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、剩0.08mol Na2CO3,得0.40mol NaCl |
| B、得0.40mol NaCl和0.16mol NaHCO3 |
| C、剩0.12mol HCl,得0.28mol NaCl和0.28mol NaHCO3 |
| D、得0.12mol NaCl和0.16mol NaHCO3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com