
 如图所示是某实验小组电解氯化钠溶液(含酚酞)的装置.有毒气体收集的装置省略没有画出,两电极均是石墨电极.
如图所示是某实验小组电解氯化钠溶液(含酚酞)的装置.有毒气体收集的装置省略没有画出,两电极均是石墨电极.分析 (1)先根据电子流向判断电源的正负极,根据电源的正负极判断a的电极名称;
(2)根据电解反应方程式中的产物确定现象;
(3)根据反应物、产物写出相应的电解方程式;
(4)先由电流、时间求出电量,再根据电量与一个电子的电量求出电子的个数,再根据电子与氢气的关系式计算氢气的体积;
(5)若将b电极换成铁作电极,电解液仍为NaCl溶液,b电极上铁失电子发生氧化反应,阴极附近生成氢氧根离子,亚铁离子和氢氧根离子生成Fe(OH)2白色沉淀,Fe(OH)2被氧化生成红褐色的Fe(OH)3.
解答 解:(1)根据电子流向,连接a的是负极,连接b的是正极,所以a是阴极,b是阳极,
故答案为:阴极;
(2)电解氯化钠溶液时,阴极上氢离子得电子生成氢气,2H2O+2e-=H2↑+2OH-,同时阴极附近生成氢氧根离子,阴极附近呈碱性,加入酚酞后溶液呈红色;阳极上氯离子失电子生成氯气,2Cl--2e-=Cl2↑,氯气是黄绿色的气体,氯气能溶于水,使溶液呈氯气的颜色;
故答案为:a极区有气泡产生、溶液变成红色;
(3)通过以上分析知,反应物是氯化钠和水,产物是氯气、氢气、氢氧化钠,电解反应为2Cl-+2H2O $\frac{\underline{\;通电\;}}{\;}$Cl2↑+H2↑+2OH-,
故答案为:2Cl-+2H2O $\frac{\underline{\;通电\;}}{\;}$Cl2↑+H2↑+2OH-;
(4)6.02min通过的电量为(6.02×60)S×l.6A,通过的电子物质的量为$\frac{(6.02×60)×l.6C}{1.6×1{0}^{-19}C×6.02×1{0}^{23}}$=6×10-3mol,
设生成氢气体积为V.
2H2O+2e-=H2↑+2OH-,
2mol 22.4L
6×10-3mol V
所以V=0.0672L=67.2mL
故答案为:67.2;
(5)若将b电极换成铁作电极,电解液仍为NaCl溶液,b电极上铁失电子发生氧化反应,电极反应式为Fe-2e-=Fe2+,阴极附近生成氢氧根离子,亚铁离子和氢氧根离子生成Fe(OH)2白色沉淀,Fe(OH)2被氧化生成红褐色的Fe(OH)3,电解总反应方程式为4Fe+10H2O+O2$\frac{\underline{\;通电\;}}{\;}$4Fe(OH)3+4 H2↑,
故答案为:4Fe+10H2O+O2$\frac{\underline{\;通电\;}}{\;}$4Fe(OH)3+4 H2↑.
点评 本题考查了电解原理,注意:电解电解质溶液时,若阳极材料是活泼金属,在阳极上金属失电子发生氧化反应,若是惰性电极作阳极,溶液中的阴离子就失电子发生氧化反应.


科目:高中化学 来源: 题型:实验题
 图为实验室制取某有机物的装置图,试通过已学知识回答下列问题:
图为实验室制取某有机物的装置图,试通过已学知识回答下列问题: .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将苯与液溴的混合物中加入铁粉制取溴苯 | |
| B. | 乙烯使酸性KMnO4溶液褪色 | |
| C. | 乙烯使溴水褪色 | |
| D. | 甲烷与氯气混合,光照后黄绿色变浅 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
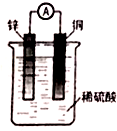
| A. | 铜片为电池的负极 | B. | 该装置将电能转化为化学能 | ||
| C. | 锌片的反应为Zn-2e-═Zn 2+ | D. | 电子由铜片经由导线流向锌片 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③④ | B. | ①④⑤ | C. | ②③④ | D. | ③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氮的非金属性比磷强,所以氮气的性质比白磷活泼 | |
| B. | ⅦA族元素一定是同周期中非金属性最强的元素 | |
| C. | IA族元素的金属性一定比IIA族元素的金属性强 | |
| D. | Na+半径大于Cl-半径 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
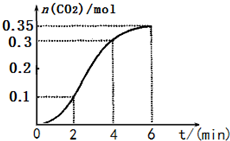
| A. | 反应开始2 min内平均反应速率最大 | |
| B. | 反应4~6 min内平均反应速率最小 | |
| C. | 反应开始4 min内温度对反应速率的影响比浓度大 | |
| D. | 反应在第2 min到第4 min间生成CO2的平均反应速率最大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ③④⑤ | B. | ②③⑥ | C. | ①③⑤ | D. | ①④⑥ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com