
| A. | 氧化物 | B. | 盐 | C. | 酸 | D. | 单质 |
 习题精选系列答案
习题精选系列答案科目:高中化学 来源: 题型:解答题
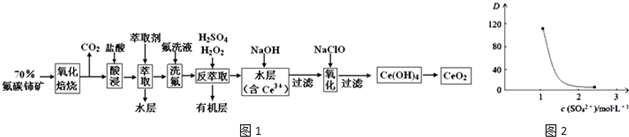
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
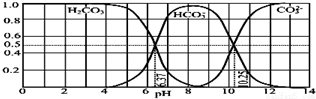
| A. | 此图是 1.0mol•L-1 碳酸钠溶液滴定 1.0mol•L-1 HCl 溶液的滴定曲线 | |
| B. | 在 pH 分别为 6.37 及 10.25 时,溶液中 c(H2CO3)=c(HCO3-)=c(CO32-) | |
| C. | 人体血液的 pH 约为 7.4,则CO2 在血液中多以 HCO3形式存在 | |
| D. | 若用CO2和NaOH反应制取Na2CO3易控制溶液的pH为7~9之间 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
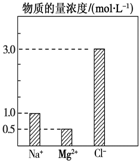 在0.2L由NaCl、MgCl2、BaCl2组成的混合液中,部分离子浓度大小如图所示,回答下列问题:
在0.2L由NaCl、MgCl2、BaCl2组成的混合液中,部分离子浓度大小如图所示,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
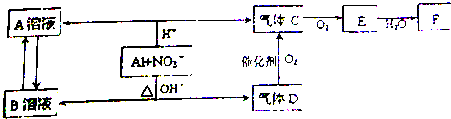
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 属于酯类的有4种 | |
| B. | 属于羧酸的有2种 | |
| C. | 既含有羟基又含有醛基的有3种 | |
| D. | 存在分子中含有六元环的同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{a}{a+b}$ | B. | $\frac{a-b}{a+b}$ | C. | $\frac{a-b}{a}$ | D. | $\frac{a+b}{a}$ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com