
 人们应用原电池原理制作了多种电池以满足不同的需要.电池发挥着越来越重要的作用,如在宇宙飞船、人造卫星、电脑、照相机等,都离不开各式各样的电池,同时废弃的电池随便丢弃也会对环境造成污染.请根据题中提供的信息,回答下列问题:
人们应用原电池原理制作了多种电池以满足不同的需要.电池发挥着越来越重要的作用,如在宇宙飞船、人造卫星、电脑、照相机等,都离不开各式各样的电池,同时废弃的电池随便丢弃也会对环境造成污染.请根据题中提供的信息,回答下列问题:分析 (1)①负极上失电子发生氧化反应;
②原电池放电时,电解质溶液中阳离子向正极移动;
③根据Na2Mn5O10和转移电子之间的关系式计算.
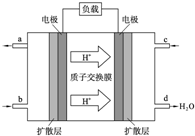
(2)①根据氢离子移动方向知,右侧电极为正极,左侧电极为负极,负极上通入燃料;
②负极上燃料失电子发生氧化反应,正极上氧化剂得电子发生还原反应;
③根据甲醇和转移电子之间的关系式计算;
(3)电池放电时正极的Ag2O2 转化为Ag,负极的Zn转化为K2Zn(OH)4,反应还应有KOH参加,依据转化写出电池反应.
解答 解:(1)①根据电池总反应:5MnO2+2Ag+2NaCl=Na2Mn5O10+2AgCl,可知Ag应为原电池的负极,负极发生反应的电极方程式为:Ag+Cl--e-=AgCl,
故答案为:Ag+Cl--e-=AgCl;
②在原电池中阴离子向负极移动,阳离子向正极移动,所以钠离子向正极移动,故答案为:正;
③根据方程式中5MnO2生成1Na2Mn5O10,化合价共降低了2价,所以每生成1molNa2Mn5O10转移2mol电子,则外电路每通过4mol电子时,生成Na2Mn5O10的物质的量是2mol,故答案为:2mol;
(2)①据氢离子移动方向知,右侧电极为正极,左侧电极为负极,负极上通入燃料甲醇,故答案为:CH3OH;
②正极上氧气得电子和氢离子反应生成水,电极反应式为:3O2+12H++12e-=6H2O,负极上甲醇失电子和水反应生成二氧化碳和氢离子,电极反应式为CH3OH-6e-+H2O=CO2+6H+,故答案为:CH3OH-6e-+H2O=CO2+6H+;
③根据2CH3OH-12e-+2H2O=2CO2+12H+知,甲醇和转移电子之间的关系式得,当6.4g甲醇完全反应生成CO2时,转移电子的物质的量═$\frac{6.4g×6}{32g/mol}$=1.2mol,则转移电子个数为1.2NA,故答案为:1.2;
(3)电池放电时正极的Ag2O2 转化为Ag,负极的Zn转化为K2Zn(OH)4,正极电极反应式为Ag2O2+4e-+2H2O═2Ag+4OH-,负极电极反应式为2Zn-4e-+8OH-═2Zn(OH)42-,反应还应有KOH参加,反应的总方程式为:Ag2O2+2Zn+4KOH+2H2O═2K2Zn(OH)4+2Ag,故答案为:Ag2O2+2Zn+4KOH+2H2O═2K2Zn(OH)4+2Ag.
点评 本题考查原电池的电极反应和离子的定向移动以及电化学的简单计算,做题时要注意总电池反应式的判断利用,运用两极上的反应特点做题,分析Mn元素的化合价变化是该题的难点.


 同步轻松练习系列答案
同步轻松练习系列答案科目:高中化学 来源: 题型:解答题
| 元素代号 | W | R | X | Y | Z | Q |
| 原子半径/nm | 0.037 | 0.186 | 0.074 | 0.075 | 0.077 | 0.110 |
| 主要化合价 | +1 | +1 | -2 | -3,+5 | +2、+4 | -3、+5 |
 ;X可与Z组成一种有恶臭味的气体丙,丙分子中各原子最外层均满足8e-结构,且含有非极性键.1mol丙气体可与2mol氧气完全反应,生成一种气体,且反应前后气体的总体积不变,该生成物能使澄清石灰水变浑浊,请写出丙分子的结构式O=C=C=C=O.
;X可与Z组成一种有恶臭味的气体丙,丙分子中各原子最外层均满足8e-结构,且含有非极性键.1mol丙气体可与2mol氧气完全反应,生成一种气体,且反应前后气体的总体积不变,该生成物能使澄清石灰水变浑浊,请写出丙分子的结构式O=C=C=C=O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 78g Na2O2与足量水反应中电子转移了0.2NA | |
| B. | 60g丙醇中存在的共价键总数为10NA | |
| C. | 分子式为C5H10O2并能与饱和NaHCO3溶液反应放出气体的有(不含立体异构)4种 | |
| D. | 1L 0.1mol•L-1的NaHCO3溶液中HCO3-和CO32-离子数之和为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蒸发时,只要蒸发皿中出现固体,立即停止加热 | |
| B. | 蒸馏时,温度计水银球应插入液体中,但不能碰到烧瓶内壁 | |
| C. | 分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 | |
| D. | 焰色反应时,用稀硫酸洗净铂丝,并在火焰上灼烧至无色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3CH(CH2Br)2 | B. | CH3CH2CHBrCH2Br | C. | CH3CHBrCHBrCH3 | D. | (CH3)2CBrCH2Br |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1个 | B. | 2个 | C. | 3个 | D. | 4个 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铝片跟氢氧化钠溶液反应:Al+4OH-═[Al(OH)4]-+H2↑ | |
| B. | 硫酸镁溶液跟氢氧化钡溶液反应:SO42-+Ba2+═BaSO4↓ | |
| C. | 氯化铝溶液中加入过量的氨水:Al3++3NH3•H2O═Al(OH)3↓+3NH4+ | |
| D. | 铜片跟稀硝酸反应:Cu+NO3-+4H+═Cu2++NO↑+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电负性:He>F>O | B. | 第一电离能:O>N>P | ||
| C. | 离子半径:S2->Cl->Ca2+ | D. | 热稳定性:H2O>H2Se>H2S |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com