
NH4Al(SO4)2是食品加工中最为快捷的食品添加剂,用于焙烤食品中;NH4HSO4在分析试剂、医药、电子工业中用途广泛。请回答下列问题:
(1)NH4Al(SO4)2可作净水剂,其理由是_________________________________
______________(用必要的化学用语和相关文字说明)。
(2)相同条件下,0.1 mol·L-1NH4Al(SO4)2中c(NH )________(填“等于”、“大于”或“小于”)0.1 mol·L-1NH4HSO4中c(NH
)________(填“等于”、“大于”或“小于”)0.1 mol·L-1NH4HSO4中c(NH )。
)。
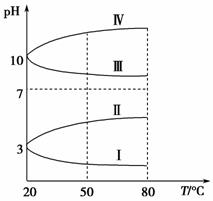
(3)如图是0.1 mol·L-1电解质溶液的pH随温度变化的图像。
①其中符合0.1 mol·L-1NH4Al(SO4)2的pH随温度变化的曲线是________(填写序号),导致pH随温度变化的原因是________________________________;
②20 ℃时,0.1 mol·L-1NH4Al(SO4)2中2c(SO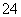 )-c(NH
)-c(NH )-3c(Al3+)=________。
)-3c(Al3+)=________。
(4)室温时,向100 mL 0.1 mol·L-1NH4HSO4溶液中滴加0.1 mol·L-1NaOH溶液,得到溶液pH与NaOH溶液体积的关系曲线如图所示:
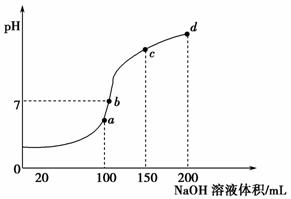
试分析图中a、b、c、d四个点,水的电离程度最大的是____________;在b点,溶液中各离子浓度由大到小的排列顺序是____________________。
解析 Al3+水解生成的Al(OH)3胶体具有吸附性,即:Al3++3H2OAl(OH)3(胶体)+3H+,Al(OH)3吸附悬浮颗粒使其沉降。NH4Al(SO4)2与NH4HSO4中的NH 均发生水解,但NH4Al(SO4)2中Al3+水解呈酸性抑制NH
均发生水解,但NH4Al(SO4)2中Al3+水解呈酸性抑制NH 水解,HSO
水解,HSO 电离出H+同样抑制NH
电离出H+同样抑制NH 水解,因为HSO
水解,因为HSO 电离生成的H+浓度比Al3+水解生成的H+浓度大,所以NH4HSO4中NH
电离生成的H+浓度比Al3+水解生成的H+浓度大,所以NH4HSO4中NH 水解程度比NH4Al(SO4)2中的小。NH4Al(SO4)2水解,溶液呈酸性,升高温度其水解程度增大,pH减小,符合的曲线为Ⅰ。根据电荷守恒,可以求出2c(SO
水解程度比NH4Al(SO4)2中的小。NH4Al(SO4)2水解,溶液呈酸性,升高温度其水解程度增大,pH减小,符合的曲线为Ⅰ。根据电荷守恒,可以求出2c(SO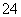 )-c(NH
)-c(NH )-3c(Al3+)=c(H+)-c(OH-)=10-3mol·L-1[c(OH-)太小,可忽略]。a、b、c、d四个点,根据反应量的关系,a点恰好消耗完H+,溶液中只有(NH4)2SO4与Na2SO4;b、c、d三点溶液均含有NH3·H2O,(NH4)2SO4可以促进水的电离,而NH3·H2O抑制水的电离,a点水的电离程度最大。b点溶液呈中性,即溶液含有(NH4)2SO4、Na2SO4、NH3·H2O三种成分,a点时c(Na+)=c(SO
)-3c(Al3+)=c(H+)-c(OH-)=10-3mol·L-1[c(OH-)太小,可忽略]。a、b、c、d四个点,根据反应量的关系,a点恰好消耗完H+,溶液中只有(NH4)2SO4与Na2SO4;b、c、d三点溶液均含有NH3·H2O,(NH4)2SO4可以促进水的电离,而NH3·H2O抑制水的电离,a点水的电离程度最大。b点溶液呈中性,即溶液含有(NH4)2SO4、Na2SO4、NH3·H2O三种成分,a点时c(Na+)=c(SO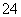 ),b点时c(Na+)>c(SO
),b点时c(Na+)>c(SO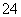 ),根据N元素与S元素的关系,可以得出c(SO
),根据N元素与S元素的关系,可以得出c(SO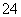 )>c(NH
)>c(NH ),故c(Na+)>c(SO
),故c(Na+)>c(SO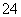 )>c(NH
)>c(NH )>c(OH-)=c(H+)。
)>c(OH-)=c(H+)。
答案 (1)Al3+水解生成的Al(OH)3胶体具有吸附性,即Al3++3H2OAl(OH)3(胶体)+3H+,Al(OH)3胶体吸附悬浮颗粒使其沉降从而净化水
(2)小于
(3)①Ⅰ NH4Al(SO4)2水解,溶液呈酸性,升高温度其水解程度增大,pH减小 ②10-3mol·L-1
(4)a c(Na+)>c(SO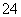 )>c(NH
)>c(NH )>c(OH-)=c(H+)
)>c(OH-)=c(H+)


 走进文言文系列答案
走进文言文系列答案科目:高中化学 来源: 题型:
下列关于碱金属的叙述中正确的是( )
A.碱金属单质与水反应都能生成碱和H2
B.碱金属单质都是质软、熔点低、密度均小于1的轻金属
C.碱金属元素随原子半径增大,原子核吸引最外层电子的能力增强
D.碱金属单质在空气中燃烧都生成过氧化物
查看答案和解析>>
科目:高中化学 来源: 题型:
常温时,某溶液中由水电离出的H+和OH-的物质的量浓度的乘积为1×10-10,则该溶液可能是 ( )。
①H2SO4;②CH3COOH;③NH4Cl;④KOH
⑤CH3COONa
A.①④⑤ B.③⑤
C.①②③ D.③
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,对于pH均为5的HCl溶液和NH4Cl溶液,下列说法正确的是 ( )。
A.两溶液稀释10倍后,pH相等
B.两溶液加热至相同的温度后,pH相等
C.两溶液中各加入等体积的pH等于9的NaOH溶液后,pH相等
D.两溶液中水的离子积相等
查看答案和解析>>
科目:高中化学 来源: 题型:
偏二甲肼与N2O4 是常用的火箭推进剂,二者发生如下化学反应:
(CH3)2NNH2 (l )+2N2O4 (l )=2CO2 (g )+3N2 (g )+4H2O (l ) (Ⅰ)
(1)若将反应(Ⅰ)设计成原电池,则正极的电极反应式为
(酸性电解质)。
(2)火箭残骸中常现红棕色气体,原因为:N2O4 (g) 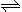 2NO2 (g) (Ⅱ)
2NO2 (g) (Ⅱ)
当温度升高时,气体颜色变深,则反应(Ⅱ)为 (填“吸热”或“放热”)反应。
(3)一定温度下,反应(Ⅱ)的焓变为ΔH。现将1 mol N2O4 充入一恒压密闭容器中,
下列示意图正确且能说明反应达到平衡状态的是________.
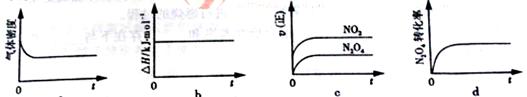
若在相同温度下,上述反应改在体积为1L的恒容密闭容器中进行,平衡常数________(填“增大”“不变”或“减小”),反应3s后NO2的物质的量为0.6mol,则0~3s内的平均反应速率v(N2O4)=________mol·L-1·s-1。
(4)NO2可用氨水吸收生成NH4NO3 。25℃时,将amol NH4NO3溶于水,溶液显酸性,原因是 (用离子方程式表示)。向该溶液滴加bL氨水后溶液呈中性,则滴加氨水的过程中的水的电离平衡将______(填“正向”“不”或
“逆向”)移动,所滴加氨水的浓度为_______mol·L-1。(NH3·H2O的电离平衡常数
Kb=2×10—5 mol·L-1)
查看答案和解析>>
科目:高中化学 来源: 题型:
.下列事实不能用平衡移动原理解释的是
|
|
|
| |||||||||||||
| A | B | C | D |
查看答案和解析>>
科目:高中化学 来源: 题型:
向体积为Va的0.05 mol/L CH3COOH溶液中加入体积为Vb的0.05 mol/L KOH溶液,下列关系错误的是 ( )
A.Va>Vb时:c(CH3COOH)+c(CH3COO-)>c(K+)
B.Va=Vb时:c(CH3COOH)+c(H+)=c(OH-)
C.Va<Vb时:c(CH3COO-)>c(K+)>c(OH-)>c(H+)
D.Va与Vb任意比时:c(K+)+c(H+)=c(OH-)+c(CH3COO-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com