
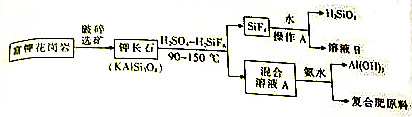
���� ��1���������ǹ��ɵؿ���ʯ����Ҫ�ɷ֣����������ε���д��дΪ���������ʽ����д��һ�㷽������Ϊ�����������������������������ˮ��xMO•nSiO2•mH2O����
��2��SiF4�ķе�ͣ����Ӧ�������������²����ķ������ˮ��Ӧ���ɹ���ͷ����⣻
��3���س�ʯ�����ᡢ�����ᷴӦ��������ء����������ķ����裬���������У����ĵ���Ҫԭ�ϳ�������������ᡢ��ˮ��
��4���ķ������ˮ��Ӧ���ɹ���ͷ����⣬����A��Ҫ�������ȡ����ˣ�SiF4������Ҫά�ֽϸ��¶ȣ���Ŀ���Ǵٽ��ķ������ˮ�⣻
��5��A��SiF4���ӷ�������
B��HF�ж�����Ӧװ��Ӧ�ܷ���У�
C������ɫ��ѧ���ա���Ԥ�������ٻ�����Ⱦ�Ļ����ֶΣ������������Ƿ�Ӧ�����ԭ��ȫ��ת��������ȡ�IJ����У���ԭ�ӵ�������Ϊ100%��
��� �⣺��1���س�ʯ���仯ѧʽΪKAlSi3O8���ù����ε���ʽ�ɱ�ʾΪ��K2O•Al2O3•6SiO2��
�ʴ�Ϊ��K2O•Al2O3•6SiO2��
��2��SiF4�����������������н��У�SiF4�ķе�Ϊ-65�棬SiF4����̬�����Ӧ�������������²����������ϣ��ķ������ˮ��Ӧ��SiF4+3H2O?H2SiO3+4HF��
�ʴ�Ϊ���²���SiF4+3H2O?H2SiO3+4HF��
��3���س�ʯ�����ᡢ�����ᷴӦ��������ء����������ķ����裬�����ҺA����Ҫ�ɷ���K2SO4��Al2��SO4��3�����������У����ĵ���Ҫԭ�ϳ�������������ᡢ��ˮ��
�ʴ�Ϊ��K2SO4��Al2��SO4��3�����ᡢ��ˮ��
��4��SiF4������Ҫά�ֽϸ��¶ȣ��ķ������ˮ��Ӧ���ɹ���ͷ����⣬���Բ���A��Ҫ�������ȡ����ˣ�������Ҫά�ֽϸ��¶ȣ���Ŀ���Ǵٽ��ķ������ˮ�⣬
�ʴ�Ϊ�����ȡ����ˣ��ٽ��ķ������ˮ�⣻
��5��A��SiF4���ӷ������壬��A����
B��HF��Ƥ����ǿ�Ҵ̼��Ժ�ʴ�ԣ��ж�����Ӧװ��Ӧ�ܷ���У���B��ȷ��
C���ù�������������ҺBΪ�������ˮ��Һ��Ϊ�ж�Һ�壬��������ɫ��ѧ���գ���C����
��ѡB��
���� ���⿼�鸻�ػ�����Ϊԭ�ϵĻ������������չ輰�仯����������ǽ��Ĺؼ�����Ŀ�Ѷ��еȣ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ���³�ѹ�£�27g Al3+�к��еĵ�����ĿΪ13 NA | |
| B�� | 22.4 L������һ������2NA����ԭ�� | |
| C�� | 23gNa��������O2��ȫȼ��������ת�Ƶ�����ΪNA | |
| D�� | ��״���£�22.4 L�Ҵ���CH3CH2OH���к��е���ԭ����ΪNA |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | H2��ȼ����Ϊ285.8 kJ/mol����H2O�����Ȼ�ѧ����ʽΪ2H2O��l���T2H2��g��+O2��g����H=+285.8 kJ/mol | |
| B�� | 1 mol CH4��ȫȼ������CO2��g����H2O��l��ʱ�ų�890 kJ�����������Ȼ�ѧ����ʽΪ $\frac{1}{2}$CH4��g��+O2��g���T$\frac{1}{2}$CO2��g��+H2O��l����H=-445 kJ/mol | |
| C�� | ��֪2C��s��+O2��g���T2CO��g����H=-221 kJ/mol����C��ȼ����Ϊ110.5 kJ/mol | |
| D�� | HF��NaOH��Һ��Ӧ��H+��aq��+OH-��aq���TH2O��l����H=-57.3 kJ/mol |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
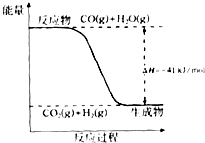 ��֪һ����̼��ˮ������Ӧ���̵������仯��ͼ��ʾ��
��֪һ����̼��ˮ������Ӧ���̵������仯��ͼ��ʾ���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ԭ�Ӱ뾶X��Y��Z | |
| B�� | �縺��X��Y��Z��˳��������ǿ | |
| C�� | �ǽ�����X��Y��Z | |
| D�� | ��̬�⻯����ȶ���X��Y��Z��˳��������ǿ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
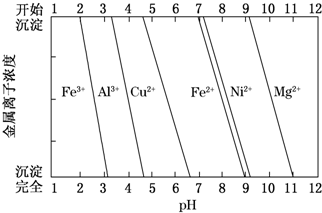
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com