
| A. | H+、Fe2+、NO3-、SO42- | B. | Al3+、Na+、SO42-、HCO3- | ||
| C. | Na+、Ca2+、Cl-、SO42- | D. | Fe3+、K+、SCN-、Cl- |
 习题精选系列答案
习题精选系列答案科目:高中化学 来源: 题型:选择题
| A. | 石油裂解主要目的是得到短链的不饱和烃 | |
| B. | 煤中含有苯和甲苯,可用先干馏后分馏的方法将它们分离出来 | |
| C. | 煤的气化与液化都是化学变化 | |
| D. | 含C18以上烷烃的重油经过催化裂化可以得到汽油 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:推断题
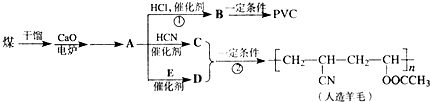
 ,CH2C═CH-CN.
,CH2C═CH-CN.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用瓷坩埚熔融氢氧化钠或碳酸钠 | |
| B. | 用玻璃棒蘸取溶液,点在湿润的pH试纸上测定溶液的pH值 | |
| C. | 取用金属钠、钾时,未用完的钠、钾应放回原瓶 | |
| D. | 读取量筒内液体的体积,俯视读数会导致读数偏小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
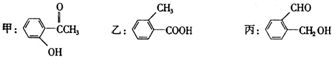
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素 性质 | A | B | C | D | E | F | G | H | I | J |
| 原子半径(10-10 m) | 1.02 | 2.27 | 0.74 | 1.43 | 0.77 | 1.10 | 0.99 | 1.86 | 0.75 | 1.17 |
| 最高 价态 | +6 | +1 | - | +3 | +4 | +5 | +7 | +1 | +5 | +4 |
| 最低 价态 | -2 | - | -2 | - | -4 | -3 | -1 | - | -3 | -4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | S$\stackrel{O_{2}点燃}{→}$ SO3$\stackrel{足量氨水}{→}$(NH4)2SO4 | |
| B. | NH3$→_{加热}^{O_{2}/催化剂}$NO$\stackrel{O_{2}}{→}$ NO2 | |
| C. | Fe$→_{加热}^{少量Cl_{2}}$ FeCl2$→_{溶液}^{NaOH溶液}$Fe(OH)2 | |
| D. | Al$→_{溶液}^{NaOH溶液}$ NaAlO2$\stackrel{足量盐酸}{→}$Al(OH)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl-一定存在,且c(Cl-)≥0.4 mol/L | |
| B. | SO42-、NH4+一定存在,Cl-可能不存在 | |
| C. | CO32-、Al3+一定不存在,K+可能存在 | |
| D. | 至少存在5种离子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com