
分析 氯水中含有的分子有HClO、Cl2、H2O,离子有Cl-、H+、ClO-等,结合离子的性质解答.
解答 解:(1)氯水中含有水,能使无水硫酸铜变蓝,故答案为:H2O;
(2)氯水溶液呈酸性,加入碳酸钠产生无色气体,故答案为:H+;
(3)次氯酸不稳定,见光易分解,反应的方程式为2HClO$\frac{\underline{\;光照\;}}{\;}$2HCl+O2↑,故答案为:HClO;
(4)氯水中加镁粉,氯水的黄绿色会褪去,原因是镁氧化盐酸反应促进氯气和水的反应,消耗氯气,溶液变为无色,故答案为:Cl2.
点评 本题以氯气的性质为载体综合考查学生实验探究和分析能力,题目难度不大,注意把握氯气的性质,根据氯水的成分进行判断.


 全优点练单元计划系列答案
全优点练单元计划系列答案科目:高中化学 来源: 题型:选择题
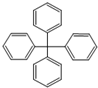
| A. | 其分子式为C25H20 | |
| B. | 分子内的所有碳原子可能共平面 | |
| C. | 完全燃烧生成CO2和H2O的物质的量之比为5:2 | |
| D. | 此分子的一氯代物有三种同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe3+、SO42-、I-、K+ | B. | K+、Al3+、SO42-、MnO4- | ||
| C. | H+、NO3-、Fe2+、Na+ | D. | Ba2+、NH4+、Br-、OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
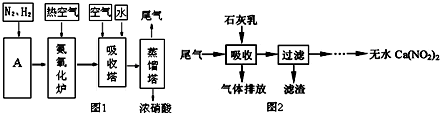
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 成分 | NaCl | Mg(OH)2 | CaCO3 | BaSO4 | SiO2等不溶于酸的物质 |
| 质量分数(%) | 15~20 | 15~20 | 5~10 | 30~40 | 10~15 |

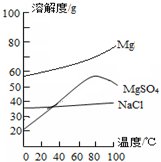
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烷(乙烯):通入足量溴水 | |
| B. | 溴乙烷(乙醇):多次加入水振荡,分液,弃水层 | |
| C. | 苯(苯酚):加溴水,振荡,过滤除去沉淀 | |
| D. | 乙酸乙酯(乙酸):加饱和碳酸钠溶液,充分振荡,分液,弃水层 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 平衡常数的大小只与温度有关,而与浓度、压强、催化剂等无关 | |
| B. | 在任何条件下,化学平衡常数都是一个定值 | |
| C. | 在平衡常数表达式中,反应物浓度用起始浓度,生成物浓度用平衡浓度 | |
| D. | 从平衡常数大小可以推断一个反应进行的快慢 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入KSCN溶液,出现红色,一定不含Fe2+ | |
| B. | 加入氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝,一定有NH4+ | |
| C. | SiO2与Al2O3都既可以与酸又可以与碱反应,故都是两性氧化物 | |
| D. | 玻璃、水泥、陶瓷、刚玉都是硅酸盐材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.01g | B. | 0.02g | C. | 0.14g | D. | 0.17g |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com