
| A、NO | B、CO | C、O2 | D、CO2 |


 一线名师权威作业本系列答案
一线名师权威作业本系列答案科目:高中化学 来源: 题型:阅读理解
| 目前空气的主要成分 | N2、O2、CO2、水蒸气及稀有气体He、Ne等 |
| 原始大气的主要成分 | CH4、NH3、CO、CO2等 |
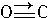 ,与CO结构最相似的分子是
,与CO结构最相似的分子是
查看答案和解析>>
科目:高中化学 来源: 题型:
| 300℃ | K2O.N2 |
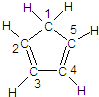 (图中数字仅代表碳原子编号),在其5个碳原子中采取sp3杂化的是
(图中数字仅代表碳原子编号),在其5个碳原子中采取sp3杂化的是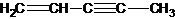 是环茂二烯的一种同分异构体,在其分子结构中处于同一平面上的原子个数最多有
是环茂二烯的一种同分异构体,在其分子结构中处于同一平面上的原子个数最多有查看答案和解析>>
科目:高中化学 来源:2011-2012学年浙江省东阳市南马高中高三下学期期中考试化学试卷 题型:填空题
16分)现有六种短周期元素A、B、C、D、E、F,其原子序数依次增大,其中B与C、D与F分别位于同一周期,A与D、C与F分别位于同一主族,且A、D两元素原子的质子数之和是C、F两元素原子质子数之和的一半。又知六种元素所形成的常见单质在常温常压下三种是气体,三种是固体。请回答下列问题:
(1)D离子的结构示意图 ;
F元素氧化物的晶体类型为 。
(2)比较B、C、D元素简单离子半径的大小: > > (填微粒符号)
(3)请说出C的氢化物比F的氢化物稳定的根本原因: ;
用高能射线照射液态水时,一个A2C分子能释放出一个电子,同时产生一种具有较
强的氧化性的阳离子,试写出阳离子的电子式: ,该阳离
子中存在的化学键有 ,并写出该阳离子与F氢化物的水溶
液反应的离子方程式: 。
(4)E是金属元素,且E单质可以与空气中的N2、CO2等反应 ,E的最高价氧化物的水化物难溶于水,已知298K时,该难溶物质的的KSP=5.6×10-12,若此时测得溶液pH
,E的最高价氧化物的水化物难溶于水,已知298K时,该难溶物质的的KSP=5.6×10-12,若此时测得溶液pH
=13.00,则此温度下残留在溶液中的E离子物质的量浓度为 mol·L-1。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年山西省高三下学期第一次月考化学试卷(解析版) 题型:选择题
某离子反应中涉及H2O、ClO—、NH4+、H+、N2、Cl—六种微粒。其中N2的物质的量随时间变化的曲线如图所示。下列判断正确的是:
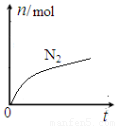
A.该反应的还原剂是Cl—
B.消耗1 mol还原剂,转移6 mol电子
C.氧化剂与还原剂的物质的量之比为2:3
D.反应后溶液的酸性明显增强
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com