
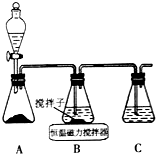
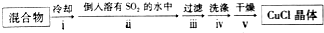
分析 (1)①A装置准备二氧化硫,B中盛放氯化铜溶液,与二氧化硫反应得到CuCl,C装置盛放氢氧化钠溶液,吸收未反应的二氧化硫,防止污染空气;
②操作ⅱ倒入溶有二氧化硫的溶液,有利于CuCl析出,二氧化硫具有还原性,可以与溶液中氧气反应;CuCl难溶于水、稀盐酸和乙醇;
③由于CuCl见光分解、露置于潮湿空气中易被氧化,应避光、密封;
④利用浓盐酸溶解CuCl生成H3CuCl4,过滤分离,再用水稀释后过滤分离;
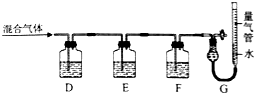
(2)①氢氧化钾会吸收二氧化碳,盐酸挥发出的HCl会影响氧气的吸收、二氧化碳的吸收,故D中盛放氢氧化钡溶液吸收二氧化碳,E中盛放保险粉(Na2S2O4)和KOH的混合溶液吸收氧气,F中盛放CuCl的盐酸溶液吸收CO,G测定氮气的体积;
②Na2S2O4在碱性条件下吸收氧气,发生氧化还原反应生成硫酸钠与水.
解答 解:(1)①A装置准备二氧化硫,B中盛放氯化铜溶液,与二氧化硫反应得到CuCl,C装置盛放氢氧化钠溶液,吸收未反应的二氧化硫,防止污染空气,
故答案为:吸收未反应的二氧化硫;
②操作ⅱ倒入溶有二氧化硫的溶液,有利于CuCl析出,二氧化硫具有还原性,可以防止CuCl被氧化;CuCl难溶于水、稀盐酸和乙醇,可以用水、稀盐酸或乙醇洗涤,减小因溶解导致的损失,
故答案为:促进CuCl析出、防止CuCl被氧化;水、稀盐酸或乙醇;
③由于CuCl见光分解、露置于潮湿空气中易被氧化,应避光、密封保存,
故答案为:避光、密封保存;
④提纯某混有铜粉的CuCl晶体实验方案:将固体溶于浓盐酸后过滤,去滤液加入大量的水稀释,过滤、洗涤、干燥得到CuCl,
故答案为:将固体溶于浓盐酸后过滤,去滤液加入大量的水稀释,过滤、洗涤、干燥得到CuCl;
(2)①氢氧化钾会吸收二氧化碳,盐酸挥发出的HCl会影响氧气的吸收、二氧化碳的吸收,故D中盛放氢氧化钡溶液吸收二氧化碳,E中盛放保险粉(Na2S2O4)和KOH的混合溶液吸收氧气,F中盛放CuCl的盐酸溶液吸收CO,G测定氮气的体积,
故答案为:氢氧化钡溶液;CuCl的盐酸溶液;
②Na2S2O4在碱性条件下吸收氧气,发生氧化还原反应生成硫酸钠与水,反应离子方程式为:2S2O42-+3O2+4OH-=4SO42-+2H2O,
故答案为:2S2O42-+3O2+4OH-=4SO42-+2H2O.
点评 本题考查物质制备实验、物质含量测定实验,属于拼合型题目,侧重考查学生对信息获取与迁移运用,关键是对原理的理解,需要学生具备扎实的基础.


 期末金牌卷系列答案
期末金牌卷系列答案 轻松课堂标准练系列答案
轻松课堂标准练系列答案科目:高中化学 来源: 题型:选择题
 电浮选凝聚法是工业上采用的一种污水处理方法:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3沉淀.Fe(OH)3有吸附性,可吸附污物而沉积下来,具有净化水的作用,其原理如图所示.下列说法正确的是( )
电浮选凝聚法是工业上采用的一种污水处理方法:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3沉淀.Fe(OH)3有吸附性,可吸附污物而沉积下来,具有净化水的作用,其原理如图所示.下列说法正确的是( )| A. | 石墨电极上发生氧化反应 | |
| B. | 根据图示,物质A为CO2 | |
| C. | 甲烷燃料电池中CO32-向空气一极移动 | |
| D. | 为增强污水的导电能力,可向污水中加入适量乙醇 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
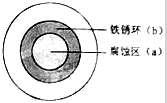 铁及其化合物与生产、生活关系密切,将NaOH溶液滴在一块光亮清洁的铁板表面上,一段时间发现液滴覆盖的圆圈中心区(a)已被腐蚀而变暗,在液滴外沿形成棕色铁锈环(b),如图所示,请回答下列问题
铁及其化合物与生产、生活关系密切,将NaOH溶液滴在一块光亮清洁的铁板表面上,一段时间发现液滴覆盖的圆圈中心区(a)已被腐蚀而变暗,在液滴外沿形成棕色铁锈环(b),如图所示,请回答下列问题查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铅蓄电池放电时,正极的质量会变小 | |
| B. | 对于某耗氧燃料电池.无论负极通入何种燃料,若转移电子总数相等,则正极消耗等质量的氧气 | |
| C. | 可以通过适当的电解装置实现反应2Ag+2H+=2Ag++H2↑ | |
| D. | 电解精炼铜,阳极为粗铜,电镀铜,阳极为纯铜 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 HCOONa加热分解时,固体失重率与温度的关系如图所示,发生的反应有:
HCOONa加热分解时,固体失重率与温度的关系如图所示,发生的反应有:| A. | T<415℃,只有反应①发生 | |
| B. | 反应①、②不可能同时发生 | |
| C. | 570℃<T<600℃时,残留固体的主要成分是Na2CO3 | |
| D. | 残留固体中的m(Na2C2O4)=m(Na2CO3)时,反应①、②的反应速率相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5KMnO4=K2MnO4+K3MnO4+K3MnO2+3O2↑ | |
| B. | 2KMnO4=K2MnO4+MnO2+O2↑ | |
| C. | 4KMnO4=2K2MnO4+2MnO2+3O2↑ | |
| D. | 3KMnO4=K3MnO4+2MnO2+2O2↑ |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年天津市高二上9月调研化学试卷(解析版) 题型:填空题
某同学在用稀硫酸与锌制取氢气的实验中,发现加入少量硫酸铜溶液可加快氢气的生成速率。请回答下列问题:
(1)上述实验中发生反应的化学方程式有________________________;
(2)硫酸铜溶液可以加快氢气生成速率的原因是_______________________;
(3)实验室中现有Na2SO4、MgSO4、Ag2SO4、K2SO4等4种溶液,可与上述实验中CuSO4溶液起相似作用的是____________;
(4)要加快上述实验中气体产生的速率,还可采取的措施有______________(答两种);
(5)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列的实验。将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需的时间。
实验 混合溶液 | A | B | C | D | E | F |
4mol·L-1H2SO4/mL | 30 | V1 | V2 | V3 | V4 | V5 |
饱和CuSO4溶液/mL | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
H2O/mL | V7 | V8 | V9 | V10 | 10 | 0 |
①请完成此实验设计,其中:V1=_________,V6=________,V9=________。
②反应一段时间后,实验A中的金属呈________色,实验E中的金属呈________色;
③该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高,但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降。请分析氢气生成速率下降的主要原因______________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年天津市高二上9月调研化学试卷(解析版) 题型:选择题
可逆反应:2NO2(g) 2NO(g)+O2(g),在体积固定的密闭容器中,达到平衡状态的标志是( )
2NO(g)+O2(g),在体积固定的密闭容器中,达到平衡状态的标志是( )
①单位时间内生成n mol O2 的同时生成2n mol NO2
的同时生成2n mol NO2
②单位时间内生成n mol O2的同时生成2n mol NO
③用NO 2、NO、O2表示的反应速率的比为2∶2∶1的状态
2、NO、O2表示的反应速率的比为2∶2∶1的状态
④混合气体的颜色不再改变的状态
⑤混合气体的密度不再改变的状态
⑥混合气体的压强不再改变的状态
⑦混合气体的平均相对分子质量不再改变的状态
A.①④⑥⑦ B.②③⑤⑦ C. ①③④⑤ D.全部
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com