
分析 (1)根据题中的知识分析反应物和生成物,然后再书写出方程式;
(2)根据得失电子守恒,H2O2中O元素的化合价由-1价变化为-2价,得到2个电子,H2O2具有氧化性,在该反应中作氧化剂,亚铁离子从+2价变为+3价,亚铁离子具有还原性,则亚铁离子前系数为2,再根据原子守恒通过观察法配平;
(3)高锰酸钾具有强的氧化性,已知溶液X可使酸性KMnO4溶液褪色发生氧化还原反应,此时H2O2表现了还原性,根据题中信息判断反应物、生成物,写出反应的离子方程式.
解答 解:(1)过氧化钠和水反应Na2O2中O元素的化合价分别由-1价变化为-2价和0价,但H2O中H和O元素的化合价不变,所以待完全反应后,得到氢氧化钠和氧气,
化学方程式为:2H2O+2Na2O2=4NaOH+O2↑,
故答案为:2Na2O2+2H2O=4NaOH+O2↑;
(2)根据得失电子守恒,H2O2中O元素的化合价由-1价变化为-2价,得到2个电子,H2O2具有氧化性,在该反应中作氧化剂,亚铁离子从+2价变为+3价,亚铁离子具有还原性,则亚铁离子前系数为2,再根据原子守恒通过观察法配平,配平后的离子方程式为:H2O2+2Fe2++4OH-=2Fe(OH)3,
故答案为:1;2;4;2;
(3)高锰酸钾具有强的氧化性,双氧水加入经酸化的KMnO4溶液中发生氧化还原反应2MnO4ˉ+5H2O2+6H+═5O2↑+2Mn2++H2O,
故答案为:2MnO4ˉ+5H2O2+6H+═5O2↑+2Mn2++H2O.
点评 本题主要考查了过氧化钠、过氧化氢的性质,题目难度中等,明确过氧化氢的氧化性、还原性是解答本题的关键.


 科学实验活动册系列答案
科学实验活动册系列答案科目:高中化学 来源: 题型:多选题
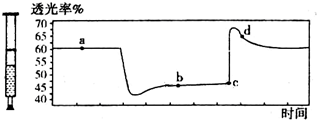 已知2NO2═N2O4+Q (Q>0),将一定量的NO2充入注射器中后封口,如图是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小).下列说法正确的是( )
已知2NO2═N2O4+Q (Q>0),将一定量的NO2充入注射器中后封口,如图是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小).下列说法正确的是( )| A. | c点的操作是拉伸注射器 | |
| B. | b点与a点相比,c(NO2)增大,c(N2O4)减小 | |
| C. | 若反应在一绝热容器中进行,则a、b两点的平衡常数Ka>Kb | |
| D. | d点:v(正)>v(逆) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 互为同位素的两种原子 | B. | 两种不同元素的原子 | ||
| C. | 一种原子和一种离子 | D. | 一种阴离子和一种阳离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液中四种粒子之间可能满足:c(Na+)>c(OH-)>c(H+)>c(CH3COO-) | |
| B. | 若溶液中部分粒子间满足:c(CH3COO-)=c(Na+),则该溶液一定呈中性 | |
| C. | 若溶液中溶质仅为CH3COONa,则粒子间一定满足:c(Na+)>c(CH3COO-)>c(OH-)>c(H+) | |
| D. | 若溶液中的溶质为CH3COONa和CH3COOH,则溶液中粒子间可能满足:c(CH3COO-)>c(Na+)>c(H+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4 L H2O所含的分子数为NA | |
| B. | 常温常压下,1 mol HD含有中子总数为2NA | |
| C. | 常温常压下,32 g O2中含有的分子数为NA | |
| D. | 100 mL 1 mol•L-1K2SO4溶液中含有的钾离子数为0.1 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铵态氮肥和草木灰?含K2CO3能混合施用 | |
| B. | 化肥和农家肥?如绿肥?不可混合施用 | |
| C. | “盐碱地”中有Na2CO3通过加石膏使之生成碳酸钙,这样根据平衡移动原理,随着c(CO32-)浓度的降低,“盐碱地”的碱性降低 | |
| D. | 复合肥?如磷酸氢二铵?和生石灰能一起施用 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | c(NH4+)>c(SO42-) | B. | c(NH4+)+c(NH3•H2O)=2c(SO42-) | ||
| C. | c(NH4+)+c(H+)=c(SO42-)+c(OH-) | D. | 加入少量NaOH固体,c(NH4+)增大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com