
将0.05mol某烃完全燃烧生成的产物依次通过浓硫酸和碱石灰,浓硫酸增重5.4克,碱石灰增重13.2克,该烃能使酸性高锰酸钾溶液褪色,若其结构中只含有一个亚甲基,则该烃的结构(不考虑立体异构)最多有
A.3种 B.4种 C.5种 D.6种
科目:高中化学 来源:2015-2016学年四川省高一下期中化学试卷(解析版) 题型:选择题
在元素周期表中,主族元素自ⅢA族的硼到ⅦA族的砹连一条斜线,即为金属和非金属的分界线,从分界线附近可以找到( )
A.耐高温材料 B.半导体材料 C.新型农药材料 D.新型催化剂材料
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河北省高二下期中化学试卷(解析版) 题型:填空题
电解法处理含氮氧化物废气,可回收硝酸,具有较高的环境效益和经济效益。实验室模拟电解法吸收NOx的装置如右图所示(图中电极均为石墨电极)。
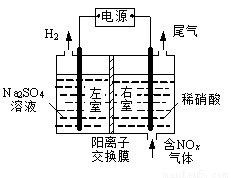
(1)若用NO2气体进行模拟电解法吸收实验。
①写出电解时NO2发生反应的电极反应式: 。
②若有标准状况下2.24 LNO2被吸收,通过阳离子交换膜(只允许阳离子通过)的H+为 mol。
(2)某小组在右室装有10 L 0.2 mol/L硝酸,用含NO和NO2(不考虑NO2转化为N2O4)的废气进行模拟电解法吸收实验。
①实验前,配制10 L 0.2mol/L硝酸溶液,需量取 mL的密度为1.4 g/mL、质量分数为63%的浓硝酸。
②电解过程中,有部分NO转化为HNO2。实验结束时,测得右室溶液中含3 molHNO3、0.1 molHNO2,同时左室收集到标准状况下28 L H2。计算原气体中NO和NO2的体积比(假设尾气中不含氮氧化物,写出计算过程)。
查看答案和解析>>
科目:高中化学 来源:2016届海南师大附中高三第九次月考化学试卷(解析版) 题型:选择题
)某有机物 X 的结构简式如下图所示,则下列有关说法中正确的是( )
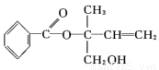
A.X的分子式为 C12H16O3
B.X在核磁共振氢谱图中共出现8组峰
C.X在一定条件下能发生加成、加聚、取代、氧化等反应
D.在Ni作催化剂的条件下,1 mol X 最多只能与5 molH2加成
查看答案和解析>>
科目:高中化学 来源:2016届海南师大附中高三第九次月考化学试卷(解析版) 题型:选择题
下列反应的离子方程式书写正确的是
A.硅酸钠溶液与醋酸溶液混合:SiO32-+2H+=H2SiO3↓
B.NaHCO3溶液中加入过量的 Ba(OH)2溶液:HCO3-+Ba2++OH-= BaCO3↓+H2O
C.氯化铝溶液中加入过量氨水 Al3++ 4NH3•H2O=AlO2-+ 4NH4++2H2O
D.用稀HNO3溶液FeS固体:FeS+2H+=Fe2++H2S↑
查看答案和解析>>
科目:高中化学 来源:2016届海南师大附中高三第九次月考化学试卷(解析版) 题型:选择题
化学与社会、环境密切相关,下列有关说法正确的是
A.蒸馏“地沟油”可以获得汽油
B.明矾水解时产生具有吸附性的胶体粒子,可作漂白剂
C.绿色化学的核心是应用化学原理对环境污染进行治理
D.高纯度的二氧化硅广泛应用于制作光导纤维,光导纤维遇强碱会“断路”
查看答案和解析>>
科目:高中化学 来源:2016届海南中学高三高考模拟九化学试卷(解析版) 题型:实验题
某研究性小组借助下列仪器装置,验证Ag与浓硝酸反应的过程中可能产生NO。从图装置C取25.00mL 待测溶液放入锥形瓶中,并滴加2 ~3滴酚酞作指示剂。用0.10 mol/ L NaOH的标准液进行滴定,到终点时,消耗NaOH溶液2.00mL。 根据此回答下列问题:
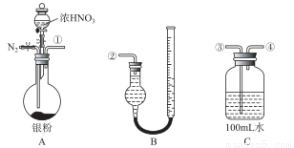
(1)滴定达到终点的标志是__________________________________;
(2)C中溶液硝酸的物质的量浓度为______________; Ag 与浓硝酸反应过程中生成标准状况下的NO2体积为_______mL。
(3)用上图所示仪器,组合一套用水吸收生成的 NO2,测定生成NO体积的装置,其合理的连接顺序是___________(填各导管的编号)。 反应前,先通入N2目的是___________________;
(4)在测定NO的体积时,B装置右边细管中液面比左边的液面高,此时应将B装置中的右边细管位置____________(“下降”或“升高”),以保证B装置中两边液面持平。
(5)若实验测得NO的体积为112.0mL(已折算到标准状况),则Ag与浓硝酸反应的过程中________(填“有”或“没有”)NO 产生,作此的依据是___________________;
查看答案和解析>>
科目:高中化学 来源:2016届海南中学高三高考模拟八化学试卷(解析版) 题型:实验题
某工厂的废渣中含NaCl、Mg ( OH) 2、CaCO3、BaCO3等,为实现变废为宝,设计了以下工艺流程制备七水硫酸镁。
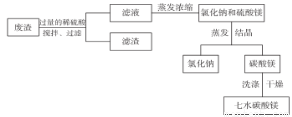
在废渣中加入过量的稀硫酸,控制 pH为5.0,温度在52℃左右,用搅拌器持续搅拌。
(1)搅拌的作用是为使反应充分进行,其化学原理为_____________________________;
(2)经过分析,过滤所得滤液中含有的离子的主要为 Na+、Mg2+、H+、SO42-、Cl-,为了除去H+,最好加入适量的_____________________________ (填化学式)。
(3)蒸发浓缩器的溶液中主要含有氯化钠和硫酸镁,通入高温水蒸汽并控制温度在100 ~ 110℃,蒸发浓缩结晶,此时析出的晶体主要是氯化钠,说明此温度下硫酸镁的溶解度比氯化钠____________ (“大”或“小”)。 结晶槽中硫酸镁结晶的方法为_______________。
(5)为了检验所得 MgSO4·7H2O 是否纯净,具体的操作为____________。
查看答案和解析>>
科目:高中化学 来源:2016届江西省高三5月月考理综化学试卷(解析版) 题型:选择题
常温下,浓度均为0.10 mol/L、体积均为V0的HA和HB溶液,分别加水稀释至体积V,pH随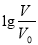 的变化如图所示,下列叙述正确的是( )
的变化如图所示,下列叙述正确的是( )
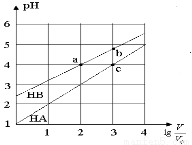
A.该温度下HB的电离平衡常数约等于1.11×10-5
B.相同条件下NaA溶液的pH大于NaB溶液的pH
C.溶液中水的电离程度:a=c>b
D.当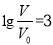 时,若两溶液同时升高温度,则
时,若两溶液同时升高温度,则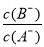 减小
减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com