
分析 碳酸氢钠受热分解反应方程式为2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O,
(1)根据方程式知,反应前后改变的质量相当于生成二氧化碳和水质量,利用差量法计算未反应碳酸氢钠质量;
(2)根据碳酸钠和二氧化碳及水质量之间关系式计算碳酸钠质量;
(3)根据Na原子守恒计算生成碳酸钠质量.
解答 解:碳酸氢钠受热分解反应方程式为2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O,
(1)根据方程式知,反应前后改变的质量相当于生成二氧化碳和水质量,
设未反应的碳酸氢钠质量为x,
2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O固体质量减少
84×2 62
(m-x)g (m-n)g
(84×2):62=(m-x)g:(m-n)g
x=$\frac{84n-53m}{31}$,
答:未反应碳酸氢钠质量为$\frac{84n-53m}{31}$g;
(2)设生成碳酸钠质量为yg
2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O固体质量减少
106 62
yg (m-n)g
106:62=yg:(m-n)g
y=$\frac{53(m-n)}{31}$,
答:生成碳酸钠质量为$\frac{53(m-n)}{31}$;
(3)根据Na原子守恒计算生成碳酸钠质量,根据钠原子守恒得n(Na2CO3)=$\frac{1}{2}$n(NaHCO3)=$\frac{mg}{84g/mol}×\frac{1}{2}×106g/mol$=$\frac{53m}{84}$g,
答:生成碳酸钠质量为$\frac{53m}{84}$g.
点评 本题考查化学方程式有关计算,侧重考查学生分析计算能力,明确各个物理量关系是解本题关键,注意 原子守恒的灵活运用,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | ②④ | B. | ①③④ | C. | ①②③ | D. | ①③⑤ |
查看答案和解析>>
科目:高中化学 来源:2017届海南省高三上学期月考三化学试卷(解析版) 题型:实验题
某班同学用如下实验探究Fe2+、Fe3+的性质。回答下列问题:
(1)甲组同学取2mL FeCl2溶液,加入几滴氯水,再加入1滴KSCN溶液,溶液变红,说明Cl2可将Fe2+氧化。FeCl2溶液与氯水反应的离子方程式为__ 。
(2)乙组同学认为甲组的实验不够严谨,该组同学在2mL FeCl2溶液中先加入0.5mL煤油,再于液面下依次加入几滴氯水和l滴KSCN溶液,溶液变红,煤油的作用是 。
(3)丙组同学取10mL 0.1mol/L KI溶液,加入6mL 0.1mol/L FeCl3溶液混合。分别取2mL此溶液于3支试管中进行如下实验:
①第一支试管中加入1mLCCl4充分振荡、静置,CCl4层呈紫色;
②第二只试管中加入1滴K3[Fe(CN)6]溶液,生成蓝色沉淀;
③第三支试管中加入1滴KSCN溶液,溶液变红。
实验②检验的离子是 (填离子符号);实验①和③说明:在I-过量的情况下,溶液中仍含有 (填离子符号) ,由此可以证明该氧化还原反应为 反应(填“可逆”或“不可逆”)。
,由此可以证明该氧化还原反应为 反应(填“可逆”或“不可逆”)。
(4)丁组同学向盛有H2O2溶液的试管中加入几滴酸化的FeCl2溶液,溶液变成棕黄色,发生反应的离子方程式为 ;一段时间后.溶液中有气泡出现,并放热,随后有红褐色沉淀生成。产生气泡的原因是 ;生成沉淀的原因是 (用平衡移动原理解释)。
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
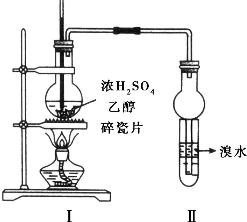 实验室制取乙烯的装置如图所示,试回答:
实验室制取乙烯的装置如图所示,试回答:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源:2017届海南省高三上学期月考三化学试卷(解析版) 题型:选择题
卤素互化物(XX’n)的性质与卤素单质相似,其中非金属性: X<X’。已知反应如下:3H2O + 2ICl3 = 5HCl + ICl + HIO3。则下列判断正确的是:( )
A.XX’n 属于活泼非金属单质
B.ICl3 属于共价化合物
C.上述反应中HCl是还原产物
D.ICl溶于水的反应:ICl + H2 O = HIO + HCl 不属于氧化还原反应
O = HIO + HCl 不属于氧化还原反应
查看答案和解析>>
科目:高中化学 来源:2017届广西桂林十八中高三上10月月考化学试卷(解析版) 题型:选择题
在两份相同的Ba(OH)2溶液中,分别滴入物质的量浓度相等的H2SO4、NaHSO4溶液,其导电能力随滴入溶液体积变化的曲线如图所示。下列分析不正确的是( )
A.①代表滴加H2SO4溶液的变化曲线
B.b点,溶液中大量 存在的离子是Na+、OH–
存在的离子是Na+、OH–
C.c点,两溶液中含有相同量的OH–
D.a、d两点对应的 溶液均显中性
溶液均显中性
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | 熔点/℃ | 沸点/℃ |
| PCl3 | -112 | 75.5 |
| POCl3 | 2 | 105.3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com