
【题目】已知:K3[Fe(CN)6]溶液是检验Fe2+的试剂,若溶液中存在Fe2+,将产生蓝色沉淀。将0.2mol/L的KI溶液和0.05mol/LFe2(SO4)3溶液等体积混合后,取混合液分别完成下列实验,能说明溶液中存在化学平衡“2Fe3++2I-![]() 2Fe2++I2”的是
2Fe2++I2”的是
实验编号 | 实验操作 | 实验现象 |
① | 滴入KSCN溶液 | 溶液变红色 |
② | 滴入AgNO3溶液 | 有黄色沉淀生成 |
③ | 滴入K3[Fe(CN)6]溶液 | 有蓝色沉淀生成 |
④ | 滴入淀粉溶液 | 溶液变蓝色 |
A.①B.②和④C.③和④D.①和②
【答案】A
【解析】
将0.2molL-1的KI溶液和0.05molL-1 Fe2(SO4)3溶液等体积混合后,I-过量,若不是可逆反应,Fe3+全部转化为Fe2+,则溶液中无Fe3+,故只需要证明溶液中含Fe3+,则即能证明此反应为可逆反应,能建立化学平衡;
①向溶液中滴入KSCN溶液,溶液变红,则说明溶液中有Fe3+,即能说明反应存在平衡,故①正确;
②向溶液中滴入AgNO3溶液有黄色沉淀生成,溶液中I-过量,无论是否存在平衡反应,都会有黄色沉淀生成,所以不能说明反应存在平衡,故②错误;
③无论反应存不存在平衡,溶液中均存在Fe2+,滴入K3[Fe(CN)6]溶液均有蓝色沉淀生成,故③错误;
④无论反应存不存在平衡,溶液中均有I2,滴入淀粉溶液后溶液均变蓝色,故不能证明存在平衡,故④错误。
故选:A。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】H2SO3水溶液中存在电离平衡H2SO3![]() H++ HSO3- 和HSO3-
H++ HSO3- 和HSO3-![]() H++ SO32-,若对H2SO3溶液进行如下操作,则结论正确的是:( )
H++ SO32-,若对H2SO3溶液进行如下操作,则结论正确的是:( )
A.通入氯气,溶液中氢离子浓度增大
B.通入过量H2S,反应后溶液pH减小
C.加入氢氧化钠溶液,平衡向右移动,pH变小
D.加入氯化钡溶液,平衡向右移动,会产生亚硫酸钡沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫化氢与浓硫酸发生如下反应:H2S+H2SO4(浓)→S↓+SO2↑+2H2O加热条件下,单质硫与浓硫酸又会发生如下反应:S+2H2SO4(浓)![]() 3SO2↑+2H2O
3SO2↑+2H2O
计算:
(1)若98%浓硫酸可表示为H2SO4aH2O,则a=__;若要把该浓硫酸转化为H2SO4H2O,则98%浓硫酸与加入水的质量比为_____。
(2)一定条件下,将0.1mol H2S气体通入足量浓硫酸中,生成b mol SO2,则 b的取值范围是_______。
(3)在50mL、4.0mol/L的NaOH溶液中,通入H2S气体并充分反应,然后,小心蒸发,得到不含结晶水的白色固体.通入H2S的物质的量为x mol,生成的白色固体的质量为7.9g,通过计算确定白色固体的可能成分及每种成分的质量(结果保留一位小数)_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某种有机化合物的结构简式如图所示。有关该物质的说法中正确的是( )
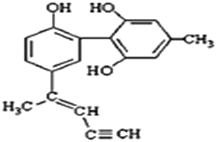
A.该物质有四种官能团,其中一种名称为羟基
B.该分子中的所有碳原子不可能共平面
C.滴入酸性KMnO4溶液振荡,紫色褪去,能证明其结构中存在碳碳双键
D.1 mol该物质与H2反应时最多消耗H2 9 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水仙花所含的挥发油中含有丁香油酚、苯甲醇、苯甲醛、桂皮醇等成分。它们的结构简式如下:
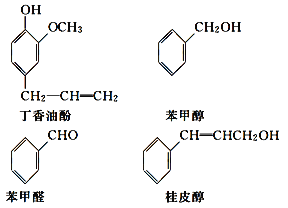
请回答下列问题:
(1)①丁香油酚中含氧的官能团是_____;丁香油酚可能具有的性质是_____(填字母)。
A.可与烧碱反应
B.只能与Br2发生加成反应
C.既可燃烧,也可使酸性KMnO4溶液褪色
D.可与NaHCO3溶液反应放出CO2气体
②从结构上看,上述四种有机物中与 互为同系物的是____(填名称)。
互为同系物的是____(填名称)。
(2)苯甲醛经________(填反应类型)反应可得到苯甲醇。写出苯甲醛和银氨溶液反应化学方程式为___________________________________。
(3)由桂皮醇转化为丙的过程为(已略去无关产物)
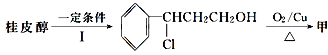
![]() 乙
乙![]() 丙
丙
如果反应Ⅱ为消去反应,则反应Ⅱ的条件是_______________,反应Ⅲ为加聚反应,则高聚物丙的结构简式为 _________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对下列各有机物同分异构体数目(不考虑立体异构)的判断中正确的是
A. 分子式为C4H8,能发生加成反应的同分异构体有2种
B. 分子式为C8H10的二甲苯,苯环上.的一个氢原子被溴原子取代,所得产物有6种
C. 分子式为C4H8Cl2,只有一个甲基的同分异构体有5种
D. 分子式为C5H10O2,只有一个官能团,且能溶于水的同分异构体有2种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】五种常见物质的转化关系如图所示(部分反应物及产物略去),其中Q、M、N含有某种相同的元素。下列说法不正确的是
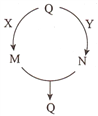
A. 若Q为N2,则X可能为氢气 B. 若Q为A1(OH)3,则Y可能为稀硫酸
C. 若Q为Fe,则Y可能为稀硝酸 D. 若Q为NaHCO3,则X可能为氢氧化钠溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钢铁制品经常进行烤蓝处理,即在铁制品的表面生成一层致密的Fe3O4。某学习小组为了研究烤蓝铁片,分别进行了以下实验操作:
①把一定量烤蓝铁片加工成均匀粉末。
②取m g该粉末,放入28.00 mL 1 mol/L的盐酸中,恰好完全反应,生成标准状况下的气体134.4 mL,向溶液中滴入KSCN溶液,无明显现象。
③再取三份不同质量的粉末,分加加到相同体积(V)、物质的量浓度均为l0.00 mol/L的三份硝酸溶液中,充分反应后,固体全部溶解,有关的实验数据如下表所示(假设NO是硝酸的唯一还原产物):
实验序号 | Ⅰ | Ⅱ | Ⅲ |
加入粉末质量/g | 13.68 | 27.36 | 34.20 |
生成气体的体积(标准状况)/L | 2.912 | 5.824 | 6.720 |
完成下列各题:
(1)实验②所得溶液中的溶质是_______(写化学式),样品中n(Fe)∶n(Fe3O4)=________,m=____________。
(2)计算实验③中每份硝酸溶液的体积(V)(mL)_________。
(3)若向实验Ⅱ所得溶液中继续加入铜粉,要使溶液中Cu2十、Fe2+、Fe3+同时存在,求加入铜粉的物质的量的范围___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】500 mL KNO3和Cu(NO3)2的混合溶液中c(NO![]() )=0.6 mol·L-1,用石墨作电极电解此溶液,当通电一段时间后,两极均收集到2.24 L气体(标准状况下),假定电解后溶液体积仍为500 mL,下列说法正确的是
)=0.6 mol·L-1,用石墨作电极电解此溶液,当通电一段时间后,两极均收集到2.24 L气体(标准状况下),假定电解后溶液体积仍为500 mL,下列说法正确的是
A.原混合溶液中c(K+)为0.2 mol·L-1
B.上述电解过程中共转移0.2 mol电子
C.电解得到的Cu的物质的量为0.05 mol
D.电解后溶液中c(H+)为0.2 mol·L-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com