
下列说法正确的是( )
A.原子序数越大,原子半径一定越大
B.电子层数越多的原子半径一定比电子层数少的原子半径大
C.元素性质的周期性变化不是元素性质的简单重复
D.按C、N、O、F的顺序,元素的最高正化合价依次升高
 精英口算卡系列答案
精英口算卡系列答案科目:高中化学 来源:2014年高一化学人教版必修二 2-2-1化学能转化为电能练习卷(解析版) 题型:选择题
锌、稀硫酸和铜组成的原电池装置中,当导线中有1 mol电子通过时,理论上两极的变化是( )
①锌片溶解32.5g;②锌片增重32.5g;
③铜片上析出1g H2;④铜片上析出1mol H2
A.①和③ B.①和④ C.②和③ D.②和④
查看答案和解析>>
科目:高中化学 来源:2014年高一化学人教版必修二 1-3-1离子键练习卷(解析版) 题型:填空题
离子化合物AB2的阴、阳离子的电子层结构相同,1 mol AB2中含54 mol电子,且有下列反应:
①H2+B2 C
C
②B2+X→Y+AB2+H2O
③Y+C→AB2+Z,Z有漂白作用。
根据上述条件回答下列问题:
(1)写出下列物质的化学式:AB2__________,X________,Y________,Z________。
(2)用电子式表示AB2的形成过程:_____________________________________________。
(3)写出反应②的化学方程式:______________________________________。
查看答案和解析>>
科目:高中化学 来源:2014年高一化学人教版必修二 1-2-2元素周期律练习卷(解析版) 题型:填空题
A、B、C、D、E为原子序数依次增大的短周期元素。已知A、B、E三原子最外层共有11个电子,且这三种元素的最高价氧化物对应的水化物之间两两皆能反应生成盐和水;C元素的最外层电子数比次外层电子数少4,D元素原子次外层电子数比最外层电子数多3。请回答下列问题:
(1)写出下列元素符号:
A________,C________,D________。
(2)写出A、B两元素最高价氧化物对应的水化物相互反应的化学方程式__________________________________________________;
A、E两元素最高价氧化物对应的水化物相互反应的化学方程式________________________。
(3)比较C、D最高价氧化物对应水化物的酸性________。
查看答案和解析>>
科目:高中化学 来源:2014年高一化学人教版必修二 1-2-2元素周期律练习卷(解析版) 题型:选择题
几种短周期元素的原子半径及主要化合价如下表:
元素代号 | X | Y | Z | W |
原子半径/pm | 160 | 143 | 70 | 66 |
主要化合价 | +2 | +3 | +5、+3、-3 | -2 |
下列叙述正确的是( )
A.X、Y元素的金属性X<Y
B.一定条件下,Z单质与W的常见单质直接生成ZW2
C.Y的最高价氧化物对应的水化物能溶于稀氨水
D.一定条件下,W单质可以将Z单质从其氢化物中置换出来
查看答案和解析>>
科目:高中化学 来源:2014年高一化学人教版必修二 1-2-1原子核外电子排布练习卷(解析版) 题型:选择题
已知一般情况下原子核外最外层电子数相等的元素具有相似的化学性质。氟元素原子的核外电子排布示意图为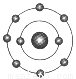 。下列原子中,与氟元素原子的化学性质相似的是( )
。下列原子中,与氟元素原子的化学性质相似的是( )
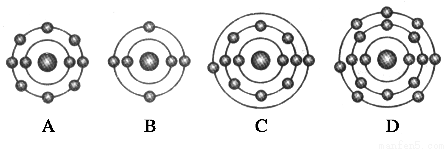
查看答案和解析>>
科目:高中化学 来源:2014年高一化学人教版必修二 1-2-1原子核外电子排布练习卷(解析版) 题型:选择题
A、B为两短周期元素,A元素原子的L层比B元素原子的L层少3个电子,B原子核外电子总数比A原子核外电子总数多5,则A和B形成的化合物的化学式为( )
A.A2B3 B.BA2 C.AB4 D.B3A2
查看答案和解析>>
科目:高中化学 来源:2014年高一化学人教版必修二 1-1-3原子结构 核素练习卷(解析版) 题型:选择题
若NA为阿伏加德罗常数,已知某元素的阴离子Rn-的原子核中,中子数为A-x+n,其中A为原子的质量数,则m g Rn-中电子总数为( )
A. B.
B.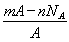
C.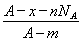 D.
D.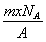
查看答案和解析>>
科目:高中化学 来源:2014年高一化学人教版必修2 模块水平检测2练习卷(解析版) 题型:实验题
酯是重要的有机合成中间体,广泛应用于溶剂、增塑剂、香料、黏合剂及印刷、纺织等工业。乙酸乙酯的实验室和工业制法常采用如下反应:
CH3COOH+C2H5OH CH3COOC2H5+H2O
CH3COOC2H5+H2O
请根据要求回答下列问题:
(1)欲提高乙酸的转化率,可采取的措施有:__________、__________等。
(2)若用如图所示的装置来制备少量的乙酸乙酯,产率往往偏低,其原因可能为________、________等。
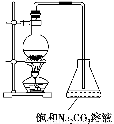
(3)此反应以浓硫酸为催化剂,可能会造成__________、__________等问题。
(4)目前对该反应的催化剂进行了新的探索,初步表明质子酸离子液体可用作此反应的催化剂,且能重复使用。实验数据如下表所示(乙酸和乙醇以等物质的量混合)。
同一反应时间 |
| 同一反应温度 | ||||
反应温度/℃ | 转化率(%) | 选择性(%)* |
| 反应时间/h | 转化率(%) | 选择性(%)* |
40 | 77.8 | 100 |
| 2 | 80.2 | 100 |
60 | 92.3 | 100 |
| 3 | 87.8 | 100 |
80 | 92.6 | 100 |
| 4 | 92.3 | 100 |
120 | 94.5 | 98.7 |
| 6 | 93.0 | 100 |
①根据表中数据,下列________(填字母)为该反应的最佳条件。
A.120 ℃,4 h B.80 ℃,2 h
C.60 ℃,4 h D.40 ℃,3 h
②当反应温度达到120 ℃时,反应选择性降低的原因可能为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com