
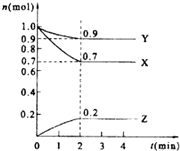
 某温度时.在2L的密闭容器中,X、Y、Z(均为气体)三种物质的量随时间的变化曲线如图所示.
某温度时.在2L的密闭容器中,X、Y、Z(均为气体)三种物质的量随时间的变化曲线如图所示.分析 (1)结合图象,可逆反应过程中,物质的转化量之比等于化学方程式中计量数之比,以此确定化学方程式中的计量数;
(2)反应开始至两分钟内,Z的物质的量变化为△n=0.2mol,以Z浓度变化表示的化学反应速率为$v(Z)=\frac{△c}{△t}=\frac{△n}{V△t}$;
(3)平衡容器内混合气体的平均相对分子质量为$\overline{M}=\frac{{m}_{混}}{n}$,混合气体的密度为$ρ=\frac{{m}_{混}}{{V}_{容器}}$,结合化学平衡的移动知识解答;
(4)按照(1)中化学反应方程式反应,列出a与c之间的关系求解;
(5)结合常用的加快化学反应速率的方法:升高温度,增加物质的浓度,压强变化等,并与勒夏特列原理的知识相结合来解答;
(6)A.改变温度,浓度等条件可以改变化学反应的限度;
B.升高温度,无论正逆反应速率,都会加快;
C.化学反应的限度与自身的性质有关;
D.当改变温度,浓度等条件时,可以改变化学反应限度;
E.增加物质的浓度,可以加快化学反应速率.
解答 解:(1)反应从起始0时刻到2min时达到反应平衡,X消耗了△n(X)=1.0-0.7=0.3mol,Y消耗了△n(Y)=1.0-0.9=0.1mol,生成了Z有△n(Z)=0.2-0=0.2mol,反应方程式的化学计量数之比就是X、Y、Z的转化量之比,为3:1:2,化学反应方程式为3X+Y?2Z,
故答案为:3X+Y?2Z;
(2)反应从0时刻开始,到2min时达到反应平衡,Z生成了0.2mol,以Z浓度变化表示的化学反应速率为$\overline{v}(Z)=\frac{△n}{V△t}=\frac{0.2mol}{2L×2min}=0.05mol/(L•min)$,
故答案为:0.05mol/(L•min);
(3)整个反应都是气体参加的反应,平衡容器内混合气体的平均相对分子质量为$\overline{M}=\frac{{m}_{混}}{n}$,反应前后,气体总的物质的量在减小,根据质量守恒定律,反应前后气体总质量不变,则混合气体平均相对分子质量增大;混合气体的密度为$ρ=\frac{{m}_{混}}{{V}_{容器}}$,反应前后气体总质量不变,容器为密闭容器,体积不发生改变,则混合气体的密度不变.故答案为:增大;不变;
(4)将amolX与bmolY混合气体发生反应:3X+Y?2Z,反应到某时刻满足n(X)=n(Y)=n(Z),设Y的转化量为cmol,则有关系:a-3c=b-c=2c,解得a=5c,b=3c,则a:b=5:3,故答案为:5:3;
(5)常用的增加化学反应速率的方法有:升高温度,增加物质的浓度,改变压强等,
A.恒压时充入He,相当于对容器内物质进行浓度的稀释,反应速率降低,故A不选;
B.恒容时充入•He,He并不参加化学反应,对恒容容器并没有影响,对化学反应速率不影响,故B不选;
C.恒容时充入X,X是反应物,相当于增加反应物的浓度,加快化学反应速率,推动平衡向右移动,故C可选;
D.及时分离出Z,减小了生成物浓度,能促使平衡向右移动,但减少物质的浓度,降低了化学反应速率,故D不选;
E.升高温度,无论是正反应还是逆反应速率,都增加反应速率,故E可选;
F.选择高效催化剂,增加化学反应速率,缩短到达平衡时所需的时间,但不改变化学平衡的限度,故F可选.
故选C、E、F;
(6)A.升高温度,可以改变平衡常数,也改变化学反应限度,故A正确;
B.升高温度,无论是正逆反应速率,都会增加,故B错误;
C.化学反应限度与物质自身和外在因素,如温度,压强,浓度等有关,与时间长短无关,故C正确;
D.升高温度,改变物质的浓度,改变压强,都可以改变化学反应限度,故D错误;
E.增加Y的浓度,正逆反应速率最终都会加快,故E错误.
故选A、C.
点评 本题主要考查化学反应速率的计算,影响因素,化学平衡的移动,结合勒夏特列原理分析化学平衡的移动,题目难度不大,是基础题.


 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案科目:高中化学 来源: 题型:选择题
| A. | 氧元素的相对原子质量为17 | |
| B. | 16O与18O核外电子排布方式不同 | |
| C. | 16O和18O的中子数分别为8和10 | |
| D. | 3.2 g16O2和3.2 g18O2均含有0.2NA个氧原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4+Cl2$\stackrel{光}{→}$CH3Cl+HCl | B. | CH2=CH2+Cl2-→CH2ClCH2Cl | ||
| C. | 2H2+O2$\frac{\underline{\;点燃\;}}{\;}$2H2O | D. | CH4+2O2$\stackrel{点燃}{→}$CO2+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

 消去反应
消去反应 取代反应.
取代反应.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 已知:下表为25℃时某些弱酸的电离平衡常数.
已知:下表为25℃时某些弱酸的电离平衡常数.| CH3COOH | HClO | H2CO3 |
| Ka=1.8×10-5 | Ka=3.0×10-8 | Ka1=4.4×10-7Ka2=4.7×10-11 |
| A. | 25℃时,相同浓度的CH3COONa溶液的碱性大于NaClO溶液 | |
| B. | 向NaClO溶液中通入少量二氧化碳的离子方程式为:2ClO-+CO2+H2O═2HClO+CO32- | |
| C. | 导电能力:c>a | |
| D. | 图象中a点酸的总浓度小于b点酸的总浓度 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该固体中只含有NH4+、Cl-、CO32-、SO42- | |
| B. | 该固体中一定没有Cu2+、Na+、Ba2+、Cl- | |
| C. | 该固体中一定含有NH4+、Na+、CO32-、SO42- | |
| D. | 根据以上实验,无法确定该固体中含有Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,80 g SO3含有的原子数目为NA | |
| B. | 常温常压下,22.4 L甲醛(HCHO)含有的原子数目为4NA | |
| C. | 铝热反应中,每1 molAl参加反应,失去的电子数目为3NA | |
| D. | 1.0L 0.5mol/LKClO3溶液中含有的氯离子数目为0.5 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学反应速率是对可逆反应而言的,非可逆反应不谈化学反应速率 | |
| B. | 对于可逆反应来说,升高温度,正反应速率与逆反应速率均会增大 | |
| C. | 化学反应速率为0.8 mol•L-1•s-1的含义是为1s时,物质的量浓度是0.8 mol•L-1 | |
| D. | 0.1 mol•L-1盐酸和0.1 mol•L-1醋酸与形状和大小相同的大理石反应的速率相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解时阴极上无金属析出的溶液:Al3+、Zn2+、Cl-、SO42- | |
| B. | 加入铁粉有氢气生成的溶液:Mg2+、K+、NO3- | |
| C. | 通入SO2后无沉淀生成的溶液:Ba2+、Fe3+、Cl-、NO3- | |
| D. | 常温下,水电离出的c(H+)=1×10-12mol/L的溶液中:Cl-、I-、Na+、K+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com