
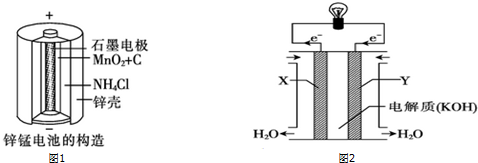
分析 (1)负极发生氧化反应,锌失电子;根据1mol的锌失去2mol的电子进行计算;
(2)该电池放电时为原电池,充电时为电解池,根据反应条件是否相同判断是否为可逆反应;
(3)甲烷燃料电池中,负极上投放燃料甲烷,发生失电子发生氧化反应,正极上投放氧气,发生得电子的还原反应.
解答 解:(1)负极发生氧化反应,锌失电子,电极反应式为:Zn-2e-=Zn2+,32.5g 锌是0.5mol,而1mol的锌失去2mol的电子,所以转移电子的物质的量为1mol,数目为NA 或6.02×1023,
故答案为:锌;Zn-2e-=Zn2+;NA 或6.02×1023;
(2)①因为电池冲放电在不同条件下进行,所以该电池反应不是可逆反应,故错误;
②因为电池冲放电在不同条件下进行,所以该电池反应不是可逆反应,故正确;
③该电池充电时,电能转变为化学能,故错误;
④该电池放电时,是将化学能转化为电能,故正确;
故选B;
(3)电解质溶液为KOH溶液,X电极失去电子,为负极,甲烷被氧化,发生失电子发生氧化反应:CH4-8e-+10OH-═CO32-+7H2O,
故答案为:负; CH4+10OH--8e-=7 H2O+CO32-.
点评 本题考查原电池以及氢氧燃料电池的工作原理,注意电解质溶液的酸碱性不同,则电极反应不同,根据得失电子判断正负极,难点是电极反应式的书写,难度不大.


 名校通行证有效作业系列答案
名校通行证有效作业系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
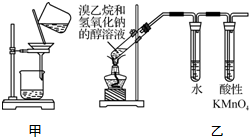
| A. | 用玻璃棒蘸取氯水点在干燥的pH试纸上,测定该溶液的pH | |
| B. | 称取4.0 g NaOH,放入100 mL容量瓶中,加水稀释,配制1.0 mol•L-1的NaOH溶液 | |
| C. | 用甲装置分离Cl2与KI溶液反应生成的碘 | |
| D. | 用乙装置检验溴乙烷与NaOH醇溶液共热产生乙烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 误食重金属盐引起人体中毒,可喝大量的食盐水解毒 | |
| B. | 石油的分馏、煤的干馏、石油的裂解都是化学变化 | |
| C. | 陶瓷、砖瓦、玻璃、水泥等,都是硅酸盐产品 | |
| D. | 钢铁制品和铜制品既能发生吸氧腐蚀又能发生析氢腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素代号 | X | Y | Z | M | R | Q | |
| 原子半径(×10-10m) | 1.86 | 0.99 | 1.43 | 1.60 | 0.75 | 0.74 | |
| 主要化合价 | 最高正价 | +1 | +7 | +3 | +2 | +5 | -- |
| 最低负价 | -- | -1 | -- | --- | -3 | -2 | |
| A. | 元素X和Q形成的化合物中不可能含有共价键 | |
| B. | X、Z、M的单质分别与水反应,Z最剧烈 | |
| C. | X、Z、R的最高价氧化物对应的水化物之间可两两相互反应 | |
| D. | Y的氧化物对应的水化物的酸性一定强于R的氧化物对应水化物的酸性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
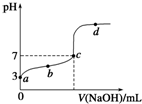 在某温度下,向20mL 0.1mol/L 某一元酸HA溶液中逐滴加入0.1mol/L NaOH溶液,其pH变化曲线如图所示(忽略温度变化).下列说法中一定正确的是( )
在某温度下,向20mL 0.1mol/L 某一元酸HA溶液中逐滴加入0.1mol/L NaOH溶液,其pH变化曲线如图所示(忽略温度变化).下列说法中一定正确的是( )| A. | a点表示溶液中c(A-)为0.1 mol/L | |
| B. | a、b、c、d点表示的溶液中一定有:c(H+)•c(OH-)=1×10-14 | |
| C. | c点表示HA和NaOH恰好反应完全 | |
| D. | b、d点表示的溶液中,其$\frac{c({H}^{+})•c({A}^{-})}{c(HA)}$值一定不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
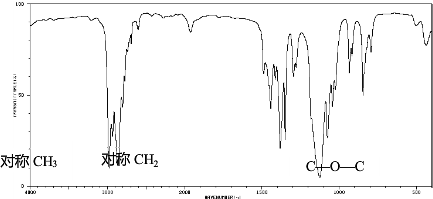
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

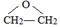 ;
; .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com