
可逆反应2SO2(g)+O2(g) 2SO3(g) △H<0, 在一定条件下达到平衡状态。在t1时刻改变某一条件,化学反应速率与反应时间的关系如右图所示。下列说法正确的是:
2SO3(g) △H<0, 在一定条件下达到平衡状态。在t1时刻改变某一条件,化学反应速率与反应时间的关系如右图所示。下列说法正确的是:
 A.维持温度、反应体系容积不变,t1时充入SO3(g)
A.维持温度、反应体系容积不变,t1时充入SO3(g)
B.维持压强不变,t1时升高反应体系温度
C.维持温度、容积不变,t1时充入一定量Ar
D.维持温度、压强不变,t1时充入SO3(g)
 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案科目:高中化学 来源: 题型:
已知C3N4晶体具有比金刚石还大的硬度,且构成该晶体的微粒间只以单键结合。下列关于C3N4晶体的说法错误的是( )
A.该晶体属于原子晶体,其化学键比金刚石中的碳碳键更牢固
B.该晶体中每个碳原子连接4个氮原子、每个氮原子连接3个碳原子
C.该晶体中碳原子和氮原子的最外层都满足8电子结构
D.该晶体与金刚石相似,都是原子间以非极性键形成空间网状结构
查看答案和解析>>
科目:高中化学 来源: 题型:
用惰性电极电解 M(NO3) x的水溶液, 当阴极上增重a g时, 在阳极上同时产生b L
氧气( 标准状况) , 从而可知 M 的原子量为:
A.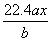 B.
B. 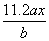 C.
C. 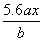 D.
D. 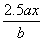
查看答案和解析>>
科目:高中化学 来源: 题型:
前四周期元素X、Y、Z、W、R的原子序数依次增大,已知:X原子的2p轨道为半充满状态;Y原子的L层有2个未成对电子;Z与Y位于同主族;W的+2价简单离子核外电子层排布与Ar原子相同;R原子的d轨道上有3个空轨道。请回答下列问题:
(1)R原子的基态电子排布式为 。
(2)X、Y原子的第一电离能大小顺序为 。(用元素符号表示)
(3)X的常见单质分子结构中σ键数目为 。
 (4)Z的最高价氧化物对应水化物的酸根离子空间构型为 ,中心原子的杂化轨道类型为 。
(4)Z的最高价氧化物对应水化物的酸根离子空间构型为 ,中心原子的杂化轨道类型为 。
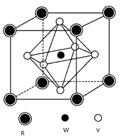
(5) 某矿物晶体由Y、W、R三种元素组成,其晶胞结构如图所示。
则该矿物的化学式为 ,若已知该晶胞的边长为a cm,
则该晶胞的密度为 g/cm3。(用含a、NA的代数式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
已知有机物A的红外光谱和核磁共振氢谱如下图,下列说法错误的是( )
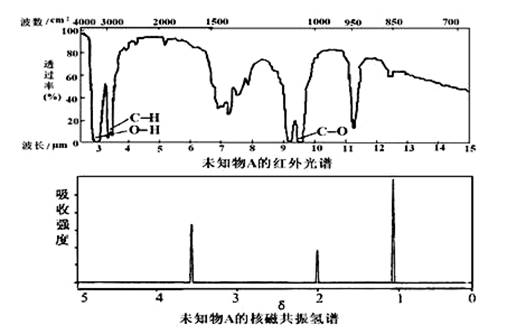
A.由红外光谱可知,该有机物中至少有三种不同的化学键
B.由核磁共振氢谱可知,该有机物分子中有三种不同化学环境的氢原子
C.仅由其核磁共振氢谱无法得知其分子中的氢原子总数
D.若A的化学式为C3H6O,则其结构简式为CH3COCH3
查看答案和解析>>
科目:高中化学 来源: 题型:
水的电离平衡曲线如下图所示。
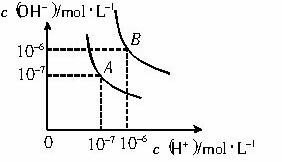
(1)若以A点表示25℃时水在电离平衡时的离子浓度, 当温度升到100℃时,水的电离平衡状态到B点,则此时水的离子积从 增加到 。
(2)常温下,将pH=10的Ba(OH)2溶液与pH=5的稀盐酸混合,然后保持100℃的恒温,欲使混合溶液pH=7,则Ba(OH)2与盐酸的体积比为 。
(3)在某温度下,Ca(OH)2的溶解度为0.74 g,其饱和溶液密度设为1 g/mL,Ca(OH)2的离子积为 。
(4))25℃时,在等体积的 ① pH=0的H2SO4溶液、②0.05mol/L的Ba(OH)2溶液,③pH=10的Na2S溶液,④pH=5的NH4NO3溶液中,发生电离的水的物质的量之比是 。
(5)等体积的下列溶液中,阴离子的总物质的量最大的是_________(填序号)。
① 0.1 mol·L-1的CuSO4溶液 ② 0.1 mol·L-1的Na2CO3
③ 0.1 mol·L-1的KCl ④ 0.1 mol·L-1的NaHCO3
(6)某二元酸(化学式用H2A表示)在水中的电离方程式是:
H2A = H+ + HA- , HA- H+ + A2- 。
H+ + A2- 。
①则Na2A溶液显________(填“酸性”“中性”或“碱性”);NaHA溶液显________(填“酸性”“中性”或“碱性”)。
②若有0.1 mol·L-1 Na2A的溶液,其中各种离子浓度由大到小的顺序是: (填序号)。
A.c(Na+)>c(A2-)>c(OH-)>c(HA-)>c(H+) B.c(Na+)>c(OH-)>c(HA-)>c(A2-)>c(H+)
C.c(Na+)>c(H+)>c(A2-)>c(OH-)>c(HA-) D.c(A2-)>c(Na+)>c(OH-)>c(H+)>c(HA-)
查看答案和解析>>
科目:高中化学 来源: 题型:
糕点包装中常见的脱氧剂组成为还原性铁粉、氯化钠、炭粉等,其脱氧原理与钢铁的吸氧腐蚀相同。下列分析正确的是
A.脱氧过程是吸热反应,可降低温度延长糕点保质期
B.脱氧过程中铁作原电池负极,电极反应为:Fe-3e-=Fe3+
C.脱氧过程中碳做原电池负极,电极反应为:2H2O+O2+4e-=4OH-
D.含有1.12g铁粉的脱氧剂,理论上最多能吸收氧气336mL(标准状况)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com