
| A. | 研发使用高效催化剂,可提高反应中原料的转化率 | |
| B. | 铅笔芯的原材料为铅,所以儿童常咬铅笔头容易铅中毒 | |
| C. | 网络飞速发展,得益于光纤良好的导电性,光纤的主要成分是二氧化硅 | |
| D. | 用K2FeO4取代Cl2处理饮用水,不仅可杀菌消毒,同时还能沉降水中的悬浮物 |
分析 A.催化剂能改变反应速率,对化学平衡移动不产生影响;
B.铅笔芯的原材料为碳;
C.二氧化硅具有良好的光学特性,不导电;
D.K2FeO4具有强氧化性,还原产物可水解生成具有吸附性的胶体.
解答 解:A.研发使用高效催化剂,可提高反应速率,不能提高原料的转化率,故A错误;
B.铅笔芯的原材料为碳,不具有毒性,故B错误;
C.二氧化硅不导电,故C错误;
D.K2FeO4具有强氧化性,还原产物可水解生成具有吸附性的胶体,可用于净水,故D正确;
故选:D.
点评 本题考查元素化合物知识,为高频考点,侧重化学与生活、生产等知识,有利于培养学生良好的科学素养,提高学习的积极性,难度不大,注意化学平衡移动影响因素.


科目:高中化学 来源: 题型:选择题
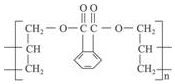 DAP是电器和仪表部件中常用的一种合成髙分子化合物(结构简式如图),合成此该高分子的单体可能是( )
DAP是电器和仪表部件中常用的一种合成髙分子化合物(结构简式如图),合成此该高分子的单体可能是( )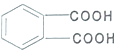
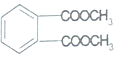
| A. | ①② | B. | ③④ | C. | ②④ | D. | ③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稳定性:NH3>H2O>H2S | B. | 氧化性:Cl2>S>P | ||
| C. | 酸性:H3PO4>H2SO4>HClO4 | D. | 碱性:Mg(OH)2>Ca(OH)2>Ba(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
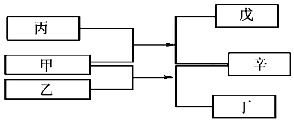 A、B、C、D是原子序数依次增大的四种短周期元素,甲、乙、丙、丁、戊是由其中的两种或三种元素组成的化合物,辛是由C元素形成的单质,常温常压下乙为液体.常温下,0.1mol/L 丁溶液的pH为13,上述各物质间的转化关系如图所示.下列说法正确的是( )
A、B、C、D是原子序数依次增大的四种短周期元素,甲、乙、丙、丁、戊是由其中的两种或三种元素组成的化合物,辛是由C元素形成的单质,常温常压下乙为液体.常温下,0.1mol/L 丁溶液的pH为13,上述各物质间的转化关系如图所示.下列说法正确的是( )| A. | 元素B、C、D的原子半径由大到小的顺序为 r(D)>r(C)>r(B) | |
| B. | 1L0.lmol/L戊溶液中阴离子的总物质的量小于0.1mol | |
| C. | 1mol甲与足量的乙完全反应共转移了约6.02×1023个电子 | |
| D. | 元素的非金属性B>C>A |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 当银针变黑时,所检验的物质有毒 | |
| B. | 银针验毒时,Ag被氧化 | |
| C. | 上述验毒反应的氧化产物和还原产物的物质的量之比为1:1 | |
| D. | 银针复原发生的反应可能为:3Ag2S+2Al═6Ag+Al2S3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径Z>W>R | |
| B. | 对应的氢化物的热稳定性:R>W>Y | |
| C. | 单质Z可与R的最高价含氧酸发生置换反应 | |
| D. | W与R所形成的简单离子均能影响水的电离平衡 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
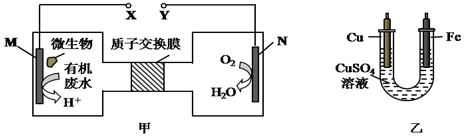
| A. | 铜电极应与Y相连接 | |
| B. | 乙装置中溶液的颜色不会变浅 | |
| C. | 当N电极消耗0.25 mol气体时,则铁电极质量增加16 g | |
| D. | M电极反应式:H2NCONH2+H2O-6e-═CO2↑+N2↑+6H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲学生用电子天平称取NaOH固体1.220g | |
| B. | 乙学生用广泛pH试纸测定溶液的酸碱性:pH=14.5 | |
| C. | 丙学生用碱式滴定管取25.0mL0.lmol/L的盐酸 | |
| D. | 丁学生用50mL 量筒量取46.70mL浓盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
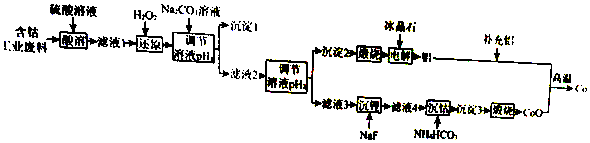
| 含钴废料的成分 | |||||
| 成分 | Al | Li | Co2O3 | Fe2O3 | 其他不溶于强酸的杂质 |
| 质量分数/% | 10.5 | 0.35 | 65.6 | 9.6 | 13.95 |
| Ⅱ.实验中部分离子开始沉淀和沉淀完全的pH | |||
| 金属离子 | Fe3+ | Co2+ | Al3+ |
| 开始沉淀的pH | 1.9 | 7.15 | 3.4 |
| 沉淀完全的pH | 3.2 | 9.15 | 4.7 |
 ]-.
]-.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com