
| A、1:1 | B、3:5 |
| C、2:3 | D、3:2 |
| 3.06g |
| 18g/mol |
| 3.36g |
| 28g/mol |
|


科目:高中化学 来源: 题型:
| A、32克氧气占有的体积约为22.4L |
| B、22.4L氮气含有阿佛加德罗常数个氮气分子 |
| C、在标况下22.4L水的质量约为18克 |
| D、22克二氧化碳与标况下11.2 LHCl约含有相同的分子数 |
查看答案和解析>>
科目:高中化学 来源: 题型:
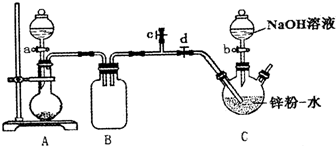 保险粉(Na2S2O4)有极强的还原性,遇水或在潮湿空气中会分解发热,甚至引起燃烧,但在碱性环境下较稳定.某实验小组利用如图装置制取保险粉,并验证其还原性.在35~45℃下,将SO2气体通入锌粉-水悬浮液中,生成ZnS2O4;待反应完全后,冷却至室温,向三颈烧瓶中加入18%的NaOH溶液,生成Na2S2O4和Zn(OH)2;经一系列操作获得无水Na2S2O4样品.
保险粉(Na2S2O4)有极强的还原性,遇水或在潮湿空气中会分解发热,甚至引起燃烧,但在碱性环境下较稳定.某实验小组利用如图装置制取保险粉,并验证其还原性.在35~45℃下,将SO2气体通入锌粉-水悬浮液中,生成ZnS2O4;待反应完全后,冷却至室温,向三颈烧瓶中加入18%的NaOH溶液,生成Na2S2O4和Zn(OH)2;经一系列操作获得无水Na2S2O4样品.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用石墨做电极时,首先在阴极放电的是Cl- |
| B、用石墨做电极时,电解一段时间后H+有可能在阴极放电 |
| C、用铁做电极时,阳极反应式:2Cl--2e-=Cl2↑ |
| D、用石墨做电极时,开始电解时Cl-与H+首先放电 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 常温下电解200mL一定浓度的NaCl与CuSO4混合溶液,理论上两极所得气体的体积随时间变化的关系如下图所示(气体体积已换算成标准状况下的体积),根据图中信息回答下列问题.
常温下电解200mL一定浓度的NaCl与CuSO4混合溶液,理论上两极所得气体的体积随时间变化的关系如下图所示(气体体积已换算成标准状况下的体积),根据图中信息回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 在一定温度下,体积为2L的密闭容器中,NO2和N2O4之间发生反应:
在一定温度下,体积为2L的密闭容器中,NO2和N2O4之间发生反应:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、v(B)=0.75 mol?L-1?s-1 |
| B、z=2 |
| C、B的转化率为25% |
| D、C的体积分数约为28.6% |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①③④ | B、③④⑦ |
| C、②③ | D、①⑤⑥ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com