
| A. | c(CH3COO-)<c(Na+) | B. | c(CH3COOH)+c(CH3COO-)=0.2mol/L | ||
| C. | c(CH3COOH)>c(CH3COO-) | D. | c(CH3COO-)>c(Na+) |
分析 物质的量浓度均为0.1mol/L的CH3COOH和CH3COONa混合溶液中,测得pH<7,即c(OH-)<c(H+),由电荷守恒可知c(OH-)+c(CH3COO-)=c(H+)+c(Na+),则测得c(CH3COO-)>c(Na+),即醋酸的电离大于醋酸根离子的水解,并结合物料守恒来解答.
解答 解:A、pH<7,即c(OH-)<c(H+),由电荷守恒可知c(OH-)+c(CH3COO-)=c(H+)+c(Na+),则测得c(CH3COO-)>c(Na+),故A错误;
B、根据物料守恒:c(CH3COOH)+c(CH3COO-)=$\frac{0.1V+0.1V}{V}$=0.2mol/L,故B正确;
C、醋酸的电离大于醋酸根离子的水解,所以c(CH3COOH)<c(CH3COO-),故C错误;
D、pH<7,即c(OH-)<c(H+),由电荷守恒可知c(OH-)+c(CH3COO-)=c(H+)+c(Na+),则测得c(CH3COO-)>c(Na+),故D正确;
故选BD.
点评 本题考查离子浓度大小的比较,明确信息及电荷守恒判断出电离与水解的程度相对大小是解答本题的关键,题目难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案 目标测试系列答案
目标测试系列答案科目:高中化学 来源: 题型:选择题
| A. | 所含质子数=A-n | B. | 所含中子数=A-Z | C. | 所含电子数=Z+n | D. | 质量数=Z+A |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
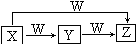 X、Y、Z、W均为中学化学常见物质,一定条件下它们有如图所示的转化关系(某些产物已略去),下列说法错误的是( )
X、Y、Z、W均为中学化学常见物质,一定条件下它们有如图所示的转化关系(某些产物已略去),下列说法错误的是( )| A. | 若X为HNO3,则W可能为Fe | |
| B. | 若W为O2,X可能是S | |
| C. | 若W为O2,则Z可能为NO | |
| D. | X→Z的离子反应可能为Al3++4OH-=AlO2-+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
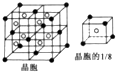 已知A、B、C、D、E、F是周期表中前四周期的六种元素,它们的性质或结构信息如表,请根据信息回答下列问题:
已知A、B、C、D、E、F是周期表中前四周期的六种元素,它们的性质或结构信息如表,请根据信息回答下列问题:| 元素 | 性质或结构信息 |
| A | 单质为黄色粉末,难溶于水,能形成2种二元含氧酸 |
| B | M层有1个未成对的p电子,核外电子总数大于7 |
| C | 与锂形成的合金常用于航天飞行器,单质能溶于强酸和强碱 |
| D | S电子总数比p电子总数少2个,单质或氧化物均具有很高的熔、沸点 |
| E | 周期表中电负性最大的元素 |
| F | 最外层有2个电子,但次外层有18个电子 |
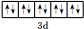 .
.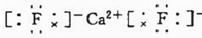 .已知该化合物晶胞$\frac{1}{8}$的体积为2.0×10-23cm3,该离子化合物的密度为3.2g/cm3(保留一位小数).
.已知该化合物晶胞$\frac{1}{8}$的体积为2.0×10-23cm3,该离子化合物的密度为3.2g/cm3(保留一位小数).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该晶体属于原子晶体,其化学键比金刚石更牢固 | |
| B. | 该晶体中每个碳原子连接4个氮原子、每个氮原子连接3个碳原子 | |
| C. | 该晶体中碳原子和氮原子的最外层都满足8电子结构 | |
| D. | 该晶体与金刚石相似,原子间都是非极性键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 燃料电池是通过燃烧方式将化学能转换为电能 | |
| B. | 氢氧燃料电池中,通入氢气的一极为正极 | |
| C. | 氢氧燃料电池是一种环境友好电池 | |
| D. | 燃料电池的能量转化率可达100% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④⑤ | B. | ②③⑤ | C. | ①③⑥ | D. | ②④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用氢氟酸在玻璃上镌刻图案:4I++SiO2═H2O+Si4+ | |
| B. | 向Cu2+、Fe3+混合液中加入CuO除去Fe3+;3H2O+3CuO+2Fe3+═2Fe(OH)3+3Cu2+ | |
| C. | 亚硫酸氢钠溶液显酸性:HSO3-═H++SO32- | |
| D. | 用盐酸与碳酸钠反应证明氯的非金属性强与炭:2H++CO32-═CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
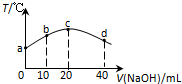 若往20mL 0.01mol•L-l HNO2(弱酸)溶液中逐滴加入一定浓度的烧碱溶液,测得混合溶液的温度变化如图所示,下列有关说法不正确的是( )
若往20mL 0.01mol•L-l HNO2(弱酸)溶液中逐滴加入一定浓度的烧碱溶液,测得混合溶液的温度变化如图所示,下列有关说法不正确的是( )| A. | HNO2的电离平衡常数:c点>b点 | |
| B. | b点混合溶液显酸性:c(Na+)>c(NO2-)>c(H+)>c(OH-) | |
| C. | c点混合溶液中:c(OH-)>c(HNO2) | |
| D. | d点混合溶液中:c(Na+)>c(OH-)>c(NO2-)>c(H+) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com