
| A. | 新制氯水、氨水的溶质分别是次氯酸、一水合氨 | |
| B. | 25℃时,pH=13的1.0L Ba(OH)2溶液中含有的OH-数目为0.2NA | |
| C. | 物质溶于水时,不一定发生化学键的断裂 | |
| D. | 烧碱、冰醋酸、四氯化碳均为电解质 |
分析 A.新制氯水的溶质为HCl和HClO;
B.依据PH计算氢离子浓度,结合溶液中离子积常数计算碱溶液中氢氧根离子浓度,水溶液中水电离也生成氢氧根离子分析判断;
C.物质溶于水时,有些物质的化学键不断裂,如蔗糖;
D.烧碱和冰醋酸是电解质,四氯化碳是非电解质.
解答 解:A.新制氯水的溶质为HCl和HClO,氨水的溶质为一水合氨,故A错误错误;
B.25℃时,pH=13的1.0L Ba(OH)2溶液中,碱含有的OH-数目为0.2NA,水存在电离生成氢氧根离子,所以溶液中氢氧根离子大于0.2NA,故B错误;
C.物质溶于水时,有些物质的化学键不断裂,如蔗糖等非电解质,故C正确;
D.烧碱和冰醋酸是电解质,四氯化碳是非电解质,故D错误;
故选C.
点评 本题考查了化学键、pH的计算、电解质和非电解质,难度不大,其中B选项注意根据溶液中OH-的来源分析.


 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铜和稀硝酸的反应:Cu2++4H++2NO3-═Cu2++2NO2↑+2H2O | |
| B. | 氯气与水反应:Fe3++Cu═Fe2++Cu2+ | |
| C. | 氯化铝溶液加入氨水:Al3++3OH-═Al(OH)3↓ | |
| D. | 实验室制氯气:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

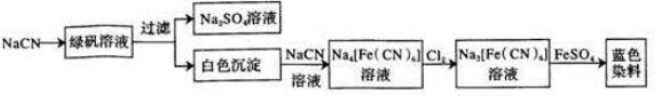
 .
. 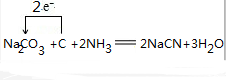 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na、Mg、Al最外层电子数依次增多,单核离子的氧化性依次增强 | |
| B. | P、S、Cl最高正化合价依次升高,对应气态氢化物的稳定性依次增强 | |
| C. | 同周期元素的原子半径以第ⅦA族的为最大 | |
| D. | Na、Mg、Al的氢氧化物的碱性依次减弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验序号 | 甲 | 乙 | 丙 |
| 合金质量/mg | 510 | 770 | 918 |
| 气体体积/mL | 560 | 672 | 672 |
| A. | 甲组和乙组的实验中,盐酸均是过量的 | |
| B. | 盐酸的物质的量浓度为1.0mol•L-1 | |
| C. | 合金中镁铝的物质的量之比为1:1 | |
| D. | 丙组中铝的物质的量为0.018mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 杂质在溶剂中的溶解度常温时很小,加热时很大 | |
| B. | 在室温时,产品在溶剂中易溶 | |
| C. | 产品在溶剂中的溶解度随温度升高而迅速增大 | |
| D. | 在同一溶剂中,产品比杂质易溶 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com