
有白色固体A与水作用生成沉淀B,B溶于浓盐酸,可得无色溶液C,若将固体A溶于稀硝酸后,加入AgNO3溶液,有白色沉淀D析出,D溶于氨水得溶液E,酸化溶液E,又析出白色沉淀D。将H2S通入溶液C,有棕色沉淀F析出,F溶于(NH4)2S得溶液G,酸化溶液G,有气体产生和黄色沉淀H,若取少量溶液C加入HgCl2的溶液中有白色I析出。问A、B、C、D、E、F、G、H、I是什么物质?写出有关推理的反应过程(不必配平,只要写出反应物及重要产物)。
分析:本题主要掌握低价锡盐是还原剂,易水解生成碱式盐和生成金属硫化物沉淀,且沉淀可生成硫代酸盐而溶解。通过此题进一步掌握IIIA、IVA、VA族的6s惰性电子对效应,即随着周期数的增加,IIIA、IVA、VA族元素的族数减去2的低价化合物较稳定。所以Tl+、Sn2+、Pb2+、Sn3+、Bi3+的化合物较稳定,其有关的盐易水解,且有SnS![]() 、SbS
、SbS![]() 、SbS
、SbS![]() 、AsS
、AsS![]() 生成。
生成。
解:A为SnCl2,B为Sn(OH)Cl,C为SnCl2溶液,D为AgCl,E为[Ag(NH3)2]Cl,F为SnS,G为SnS![]() , H为SnS2,I为Hg2Cl2。
, H为SnS2,I为Hg2Cl2。
推理其反应过程(反推法)
(1)SnCl2 +HgCl2 → Hg2Cl2↓(白色)+SnCl4
(2)SnS![]() + 3H+ → SnS2 ↓+ H2S↑
+ 3H+ → SnS2 ↓+ H2S↑
(3) SnS + S![]() → SnS
→ SnS![]()
(4)SnCl2 + H2S → SnS↓
(5)AgCl + 2NH3 → [Ag(NH3)2]Cl ![]() AgCl↓
AgCl↓
(6)Ag+ + Cl- → AgCl↓
(7)Sn(OH)Cl + H+ → SnCl2 + H2O
(8)SnCl2 + H2O → Sn(OH)Cl


科目:高中化学 来源: 题型:

| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
 工业上冶炼冰铜(mCu2O?nFeS)可得到粗铜,再以粗铜为原料制备硫酸铜晶体.
工业上冶炼冰铜(mCu2O?nFeS)可得到粗铜,再以粗铜为原料制备硫酸铜晶体.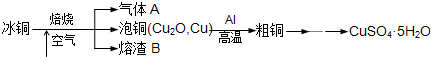
| ||
| ||
| 滴定剂 |
| 5bc |
| 4a |
| 5bc |
| 4a |
查看答案和解析>>
科目:高中化学 来源:2012-2013学年上海市杨浦区高三上学期学业质量调研化学试卷(解析版) 题型:实验题
工业上冶炼冰铜(mCu2O·nFeS)可得到粗铜,再以粗铜为原料制备硫酸铜晶体。
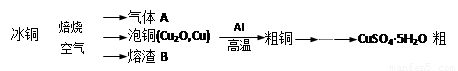
完成下列填空:
(1)气体A中的大气污染物可选用下列试剂中的 (填序号)吸收。
a. 浓H2SO4 b. 浓HNO3 c. NaOH溶液 d. 氨水
(2)用稀H2SO4 浸泡熔渣B,取少量所得溶液,滴加 (填物质名称)溶液后呈红色,说明溶液中存在Fe3+,检验溶液中还存在Fe2+的方法是 (注明试剂、现象)。
|

(3)泡铜冶炼粗铜的化学方程式是 。
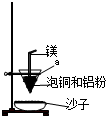
(4)装置中镁带的作用是 。泡铜和铝粉混合物表面覆盖少量白色固体a,
a是 (填名称)。沙子能否换成水? (填“能”或“不能”)。
(5)用滴定法测定CuSO4·5H2O的含量。取a g试样配成100 mL溶液,取20.00mL用c mol /L 滴定剂(H2Y2–,滴定剂不与杂质反应)滴定至终点,消耗滴定剂bmL,滴定反应:Cu2+ + H2Y2–=CuY2–+ 2H+。则CuSO4·5H2O质量分数的表达式是 。
(6)下列操作会导致CuSO4·5H2O含量的测定结果偏高的是_____________。
a.滴定临近终点时,用洗瓶中的蒸馏水洗下滴定管尖嘴口的半滴标准液至锥形瓶中
b.滴定管用蒸馏水洗涤后,直接注入待测液,取20.00mL进行滴定
c.滴定前,滴定管尖端有气泡,滴定后气泡消失
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com