
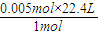 =0.112L=112mL,
=0.112L=112mL,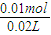 =0.5mol/L,
=0.5mol/L,

科目:高中化学 来源: 题型:
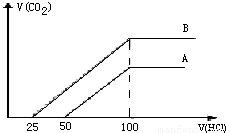
 取等物质的浓度NaOH溶液两份A和B,每份20ml,向其中各通入一定量的CO2,然后分别将其稀释为100ml,分别向稀释后的溶液中逐滴加入0.1mol/L的盐酸,标准状况下产生CO2气体体积与所加盐酸的体积(单位为ml)的关系如图所示.
取等物质的浓度NaOH溶液两份A和B,每份20ml,向其中各通入一定量的CO2,然后分别将其稀释为100ml,分别向稀释后的溶液中逐滴加入0.1mol/L的盐酸,标准状况下产生CO2气体体积与所加盐酸的体积(单位为ml)的关系如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:
 取等物质的量浓度的NaOH溶液两份A和B,每份10mL,分别向A、B中通入不等量的CO2,再继续向两溶液中逐滴加入0.1 mol/L的盐酸,标准状况下产生的CO2的体积与所加盐酸体积之间的关系如图所示,试回答下列问题:
取等物质的量浓度的NaOH溶液两份A和B,每份10mL,分别向A、B中通入不等量的CO2,再继续向两溶液中逐滴加入0.1 mol/L的盐酸,标准状况下产生的CO2的体积与所加盐酸体积之间的关系如图所示,试回答下列问题:查看答案和解析>>
科目:高中化学 来源:四川省华蓥中学2008届高三第一次月考化学试题 题型:022
取等物质的浓度NaOH溶液两份A和B,每份20 ml,向其中各通入一定量的CO2,然后分别将其稀释为100 ml,分别向稀释后的溶液中逐滴加入0.1 mol/L的盐酸,标准状况下产生CO2气体体积与所加盐酸的体积(单位为ml)的关系如下图所示

(1)曲线A表明,原溶液中通入CO2后,所得溶液中的溶质为(写化学式)________,加入盐酸后产生CO2体积的最大值________ml,滴入盐酸的过程中发生反应的离子方程式________、________.
(2)曲线B表明,原溶液中通入CO2后,所得溶液中的溶质为(写化学式)________,两溶质物质的量之比为________;加入盐酸后产生CO2体积的最大值为________ml.
(3)求原NaOH溶液物质的量的浓度________mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 取等物质的浓度NaOH溶液两份A和B,每份20ml,向其中各通入一定量的CO2,然后分别将其稀释为100ml,分别向稀释后的溶液中逐滴加入0.1mol/L的盐酸,标准状况下产生CO2气体体积与所加盐酸的体积(单位为ml)的关系如图所示.
取等物质的浓度NaOH溶液两份A和B,每份20ml,向其中各通入一定量的CO2,然后分别将其稀释为100ml,分别向稀释后的溶液中逐滴加入0.1mol/L的盐酸,标准状况下产生CO2气体体积与所加盐酸的体积(单位为ml)的关系如图所示.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com