
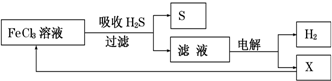
| A. | 吸收H2S的离子方程式为:2Fe3++H2S=2Fe2++S↓+2H+ | |
| B. | 电解时选用阴离子交换膜,电解过程中的阳极区反应主要为:2Cl--2e-=Cl2 | |
| C. | 电解过程中若阴极产生2.24L气体,则阳极区产生0.2mol Fe3+ | |
| D. | 实验室可用点燃充分燃烧的方法消除H2S污染 |
分析 A、根据Fe3+的氧化性和H2S的还原性,再根据离子方程式正误的判断;
B、根据氯化亚铁溶液中离子的放电顺序结合实验还能制取H2和S得情况来判断;
C、根据电极反应式以及电子守恒进行计算即可,注意气体的体积和物质的量之间的计算关系;
D、H2S充分燃烧的产物为二氧化硫.
解答 解:A、由图中的流程图可知,FeCl3与H2S反应生成S和Fe2+,离子方程式为:2Fe3++H2S=2Fe2++S↓+2H+,故A正确;
B、电解的是氯化亚铁和盐酸溶液,在阴极区域产生的是氢气,为了制得氢气,应该是采用阳离子交换膜,让氢离子通过,阳极发生的应该是氧化反应,所得滤液中含有Fe2+、H+和Cl-,由于还原性Fe2+>Cl-(或根据图示循环),电解时阳极反应式为Fe2+-e-═Fe3+,故B错误;
C、电解过程中若阴极产生2.24L氢气,在标况下,其物质的量为:0.1mol,根据阴极反应:2H++2e-=H2↑,则转移电子是0.2mol,电解时阳极反应式先是:Fe2+-e-═Fe3+,阳极区产生0.2mol Fe3+,故C错误;
D、由于H2S充分燃烧的化学方程式为2H2S+3O2═2SO2+2H2O,生成的SO2也是一种有毒气体,故D错误.
故选:A.
点评 本题考查的知识点较多,电解池的工作原理、离子方程式正误判断、电极反应式的书写,试题的综合性较强.


 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案科目:高中化学 来源: 题型:选择题
| 实验 |  | ||||
| 记录 | A | 无色 | 无色 | 无现象 | 无色溶液 |
| B | 红色 | 无色 | 白色沉淀 | 白色沉淀 | |
| C | 红色 | 无色 | 无色溶液 | 白色沉淀 | |
| D | 无色 | 无色 | 无色溶液 | 无色溶液 | |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
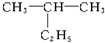 命名为“2-乙基丙烷”,错误原因是主链选错;将其命名“3-甲基丁烷”,错误原因是编号错误.正确的命名为2-甲基丁烷.
命名为“2-乙基丙烷”,错误原因是主链选错;将其命名“3-甲基丁烷”,错误原因是编号错误.正确的命名为2-甲基丁烷.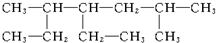 的名称为2,5-二甲基-4-乙基庚烷.
的名称为2,5-二甲基-4-乙基庚烷.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N2 | B. | NO2 | C. | NH3 | D. | NO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③ | B. | ②⑤ | C. | ③④ | D. | ①③ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应为吸热反应 | B. | CO2分子中的化学键为非极性键 | ||
| C. | HCHO分子中含δ键又含π键 | D. | 每生成1.8gH2O消耗2.24LO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com