
亚氯酸钠(NaClO2)是一种重要的含氯消毒剂,常用于水的消毒以及纺织高漂白。过氧化氢法生产亚氯酸钠的流程图如下
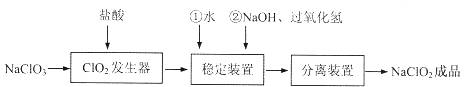
已知NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出NaClO2·3H2O且NaClO2在碱性条件下稳定性较高。试回答下列问题:
(1)在ClO2发生器中同时有氯气产生,则在发生器中发生反应的化学方程式为
(2)在NaClO2稳定装置中,H2O2作 (选填序号)。
A.氧化剂 B.还原剂
C.既作氧化剂又作还原剂 D.既不作氧化剂也不作还原剂
(3)在实验室模拟“固体分离装置”中的技术,必须进行的实验操作是 (按实验后顺序填写操作代号)。
A.过滤 B.加热 C.分液 D.蒸馏 E.冷却
(4)经查阅资料知道:当pH≤2.0时,ClO-2能被I完全还原成Cl—;
溶液中Na2S2O3能与I2反应生成NaI和Na2S4O6。
欲测定成品中NaClO2的含量,现进行如下操作:

①步骤Ⅱ中发生反应的离子方程式是 ,
步骤Ⅲ中达到滴定终点时的现象是 。
②若上述滴定操作中用去了V mL Na2S2O3溶液,则样品中NaClO2的质量分数 (用字母表示)。
【知识点】工艺流程题 A4 B1 D2 C1 J1 B2
【答案解析】(1)2NaClO3+4HCl=2ClO2↑+Cl2↑+2NaCl+2H2O
(2)B (3)BEA
(4)ClO2-+4H++4I-=2I2+Cl-+2H2O
滴入最后一滴标准液(Na2S2O3溶液),溶液由蓝色变为无色,且半分钟内不变色
9.05×10-2VC/4W
解析: ⑴ClO2发生器中有氯气产生,是NaClO2氧化浓盐酸:2NaClO3+4HCl=2ClO2↑+Cl2↑+2NaCl+2H2O
⑵ClO2在稳定装置中变为NaClO2,发生的是还原反应,因此H2O2作还原剂
⑶根据NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出NaClO2·3H2O知采取冷却结晶的方法,即加热→冷却→过滤。
⑷①根据当pH≤2.0时,ClO-2能被I完全还原成Cl—知步骤Ⅱ中发生反应是ClO2-将I-氧化为I2,步骤Ⅲ发生的反应是2Na2S2O3+I2=2NaI+Na2S4O6,即终点时的现象是滴入最后一滴标准液(Na2S2O3溶液),溶液由蓝色变为无色,且半分钟内不变色
②NaClO2~2I2~4 Na2S2O3
90.5 4mol
m VC×10-3,m=9.05×10-2VC/4,因此质量分数为9.05×10-2VC/4W
【思路点拨】多步反应计算采取关系式法;根据物质的溶解度随温度的变化结晶方法有蒸发结晶(物质的溶解度随温度的变化小)和冷却结晶(物质的溶解度随温度的变化大)。


 小学课时特训系列答案
小学课时特训系列答案科目:高中化学 来源: 题型:
科技工作者提出用铝粉处理含亚硝酸盐废水的思路:调节亚硝酸盐废水酸碱性,使其pH>12,然后加入适量的铝粉、搅拌,从而实现预期目的。下列判断错误的是
A.废水处理时铝单质转化为Al3+ B.废水处理中,亚硝酸盐被还原
C.处理过程中,OH一参与了反应 D.铝粉颗粒大小影响废水处理的速率
查看答案和解析>>
科目:高中化学 来源: 题型:
碲(Te)为ⅥA族元素,是当今高新技术新材料的主要成分之一。工业上可从电解精炼铜的阳极泥中提取碲。
(1)粗铜中含有Cu和少量Zn、Ag、Au、TeO2及其他化合物,电解精炼后,阳极泥中主要含有TeO2、少量金属单质及其他化合物。电解精炼粗铜时,阳极电极反应式为____________。
(2)TeO2是两性氧化物,微溶于水,可溶于强酸或强碱。从上述阳极泥中提取碲的一种工艺流程如下:
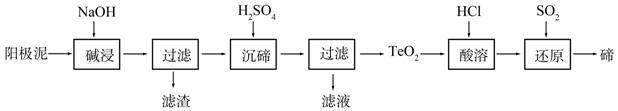
①“碱浸”时TeO2发生反应的化学方程式为_______________________________________。
②“沉碲”时控制溶液的pH为4.5-5.0,生成TeO2沉淀。如果H2SO4过量,溶液酸度过大,将导致碲的沉淀
不完全,原因是____________________________________;防止局部酸度过大的操作方法是_______________________________________________________________。
③“酸溶”后,将SO2通入TeCl4溶液中进行“还原”得到碲,该反应的化学方程式是
______________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
某烯烃的结构简式为
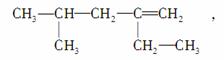
有甲、乙、丙、丁四位同学分别将其命名为:2甲基4乙基4戊烯;2异丁基1丁烯;2,4二甲基3己烯;4甲基2乙基1戊烯,下面对4位同学的命名判断正确的是( )
A.甲的命名中主链选择是错误的
B.乙的命名中对主链碳原子的编号是错误的
C.丙的命名中主链选择是正确的
D.丁的命名是正确的
查看答案和解析>>
科目:高中化学 来源: 题型:
向100mL的FeBr2溶液中,通入标准状况下Cl2 5.04L,Cl2全部被还原,测得溶液中c(Br-)=c(Cl-),则原FeBr2溶液的物质的量浓度是
A.0.75mol/L B.1.5mol/L C.2mol/L D.3mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
三氯异氰尿酸(结构简式如图)是养蚕业和水产养殖业最重要的消毒剂,三氯异氰尿酸水解生成X和NH4HCO3。下列关于X的说法不正确的是
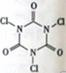
A.X的结构式为H—Cl—O B.X有强氧化性
C.X属于弱酸 D.X属于电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
汽车尾气中CO、NOx 以及燃煤废弃中的SO2都是大气污染物,对它们的治理具有重要意义。
Ⅰ.CH4(g)+4NO2(g) = 4NO(g)+CO2(g)+2H2O(g) △H1= —574 kJ·mol- 1 .
CH4(g) + 4NO(g) = 2N2(g)+CO2(g)+2H2O(g) △H2= 一1160 kJ·mol- 1
(1)甲烷直接将NO2还原为N2的热化学方程式为 ;
Ⅱ.吸收SO2和NO,获得Na2S2O4和NH4NO3产品的流程图如下(Ce为铈元素):

(2)装置Ⅱ中,酸性条件下,NO被Ce 4+ 氧化的产物主要是NO3- 、NO2- ,写出只生成NO3- 的离子方程式 ;
(3)装置Ⅲ的作用之一是再生Ce4+,其原理如下图所示。
①生成的Ce4+ 从电解槽的 (填字母序号)口流出;
②生成S2O42 - 的电极反应式为 ;
(4)已知进入装置Ⅳ的溶液中,NO2- 的浓度为a g·L- 1 ,要
使1m3该溶液中的NO2- 完全转化为NH4NO3,至少需向装置Ⅳ
中通入标准状况下的O2 L。(用含a代数式表示,计算结果保留整数)


查看答案和解析>>
科目:高中化学 来源: 题型:
在化学学习、研究中,类推的思维方法有时会产生错误的结论,因此类推的结论最终要经过实践的检验才能确定其正确与否。下列几种类推结论中正确的是
A. CO2和Na2O2反应生成Na2CO3,推测:SO2和Na2O2反应生成Na2SO3
B.金属钠着火不能用CO2扑灭,推测:金属钾着火也不能用CO2扑灭
C. Fe3O4可表示为FeO·Fe2O3,推测:Pb3O4也可表示为PbO·Pb2O3
D. F、Cl、 Br,、I的单质熔点依次升高,推测:N、 P、As、 Sb、Bi单质熔点也依次升高
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com