
【题目】(1)蛋白质主要是由_____、_____、_____、_____四种元素组成,它们的一级结构是多个不同的氨基酸通过_________结合而成的。已知某蛋白质含氮的质量分数为15%,若成人每天排出尿素[化学式为CO(NH2)2]23克,则每天从食物中摄取的蛋白质的质量平均值为______克。
(2)用5.0千克含淀粉80%(质量分数)的玉米制取葡萄糖,反应的方程式为________________,若转化率为90%,可以制得葡萄糖的质量是______千克。
科目:高中化学 来源: 题型:
【题目】H2O2分解速率受多种因素影响。实验测得70℃时不同条件下H2O2浓度随时间的变化如图所示。下列说法正确的是( )
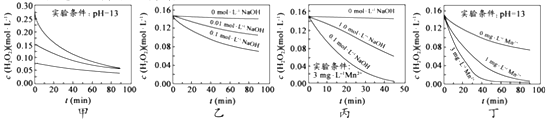
A. 图甲表明,其他条件相同时,H2O2浓度越小,其分解速率越快
B. 图乙表明,其他条件相同时,溶液PH 越小,H2O2分解速率越快
C. 图丙表明,少量Mn2+存在时,溶液碱性越强,H2O2分解速率越快
D. 图丙和图丁表明,碱性溶液中,Mn2+对H2O2分解速率的影响大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在体积为V L的恒容密闭容器中盛有一定量H2,通入Br2(g)发生反应H2(g)+Br2(g)![]() 2HBr(g);ΔH<0。当温度分别为T1、T2,平衡时,H2的体积分数与Br2(g)的物质的量变化关系如图所示。下列说法正确的是
2HBr(g);ΔH<0。当温度分别为T1、T2,平衡时,H2的体积分数与Br2(g)的物质的量变化关系如图所示。下列说法正确的是
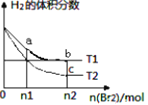
A.若b、c两点的平衡常数分别为K1、K2,则K1>K2
B.a、b两点的反应速率:b>a
C.为了提高Br2(g)的转化率可采取增加Br2(g)通入量的方法
D.b、c两点的HBr的体积分数b>c
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸铝是一种具有广泛用途的重要化工产品,以高岭土(含SiO2、A12O3、少量Fe2O3 等)为原料制备硫酸铝晶体[Al2(SO4)3·18H2O]的实验流程如图所示。
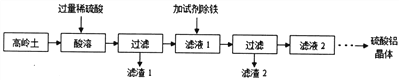
回答以下问题
(1)高岭土需进行粉粹,粉粹的目的是_____________________。
(2)滤渣1经过处理可作为制备水玻璃(Na2SiO3水溶液)的原料,写出滤渣1与烧碱溶液反应的化学方程式____________________________________。
(3)加入试剂除铁前,滤液1中的阳离子除了Al3+、Fe3+外还有的阳离子是__________(填离子符号)。滤渣2主要成分为Fe(OH)3,由于条件控制不当,常使Fe(OH)3 中混有Al(OH)3影响其回收利用,用离子方程式表示除去A1(OH)3的原理____________________________________________。
(4)检验滤液2中是否含有Fe3+的实验方法是(要求写出实验步骤和现象):__________________。
(5)要从滤液2获取硫酸铝晶体需要经过多步处理,其中从溶液中得到晶体的方法是__________(填标号)。
a.蒸发结晶 b.蒸发浓缩、冷却结晶
(6)某兴趣小组为了测定晶体中Al2(SO4)3·18H2O(M=666g·mol-1)的质量分数,进行如下实验:
①准确称取l.00g晶体样品,溶于一定量水中;
②滴入0.100 mol·L-1 EDTA溶液,与Al3+反应所消耗EDTA溶液的体积25.00 mL。 (已知:EDTA与Al3+以物质的量之比1∶1反应,假设杂质不与EDTA反应)则晶体中Al2(SO4)3·18H2O的质量分数是__________;若样品中的杂质离子能与EDTA反应,所测定质量分数将会__________(填“偏高”、“偏低”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氯化二硫(S2C12)是工业上常用的硫化剂。常温下是一种液体,沸点137℃,易与水反应。实验室可通过硫与少量氯气在110140℃反应制得S2Cl2粗品,氯气过量则会生成SCl2。
(1)选取以下装置制取少量S2Cl2:

①仪器m的名称为_____________。
②装置连接顺序:A→________________________________→E→D。
③A中发生反应的离子方程式为 _________________________。
④装置F的作用是____________________。
⑤D中的最佳试剂是__________(填标号)。
a.碱石灰 b.浓硫酸 c.无水氯化钙
⑥为了提高S2Cl2的纯度,关键的是控制好温度和_______________________。
(2)S2Cl2遇水会生成SO2、HCl两种气体,某同学设计了如下实验方案来测定该混合物的SO2的体积分数。

①W溶液可以是下列溶液中的__________(填标号);
a.H2O2溶液 b.KMnO4溶液(硫酸酸化) c.氯水
②该混合气体中二氧化硫的体积分数为__________(含V、m的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有几种有机物之间的转化关系如图所示(部分产物和条件省略),已知A为氯代醇。

请根据上述信息,回答下列问题:
(1)A的结构简式 _________________________ ,G的结构简式 _______________________ ,
H中官能团的电子式 ____________________ 。
(2)上述流程中,有机反应类型相同的是 ________ 。
A.①② B.③④ C.⑤⑨ D.⑦⑧
(3)下列有关E的说法正确的是 ________ 。
A.E属于二元醇
B.E能与钠反应产生气体
C.E能使溴的四氯化碳溶液褪色
D.E能发生银镜反应
(4)I有多种同分异构体,写出同时满足下列条件的I的所有同分异构体的结构简式: ____________________________________________________________ 。
①能水解且能与新制氢氧化铜反应生成砖红色固体; ②能与钠反应放出气体。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(10分)金属镍及其化合物在合金材料以及催化剂等方面应用广泛。
(1)基态镍原子的外围电子排布式为 。
(2)金属镍能与CO形成配合物Ni(CO)4,写出与CO互为等电子体的一种分子和一种离子的化学式 、 。
(3)很多不饱和有机物在Ni催化下可与H2发生加成反应。
如①CH2=CH2、②HC≡CH、③![]() 、④HCHO,其中碳原子采取sp2杂化的分子有
、④HCHO,其中碳原子采取sp2杂化的分子有
(填物质序号),HCHO分子的立体结构为 形。
(4)金属镍与镧(La)形成的合金是一种良好的储氢材料,其晶胞结构示意图如左下图所示。该合金的化学式为 。
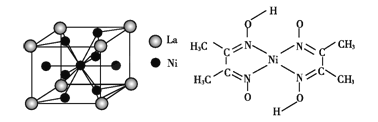
(5)丁二酮肟常用于检验Ni2+:在稀氨水中,丁二酮肟与Ni2+反应生成鲜红色沉淀,其结构如上右图所示。该结构中,除共价键外还存在配位键和氢键,请在图中用箭头和“…”表示出配位键和氢键。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)关注营养平衡,合理使用药物,有利于身心健康,现有下列四种物质:
A、麻黄碱 B、西红柿 C、青霉素 D、阿司匹林
①富含维生素的是________;
②用于治疗哮喘、鼻粘膜充血引起的鼻塞等,但属于国际奥委会严格禁止的兴奋剂的是_________;
③用作抗生素,在使用时需要进行皮肤敏感实验的是________;
④能起镇热解痛作用的是_______ ;
(2)化学是材料科学发展的基础,合理使用材料有利于人类的生产和生活。
①下列物质中含有机高分子材料的是_________________ ;
A、汽车轮胎 B、陶瓷 C、玻璃
②下列防止钢铁锈蚀的措施不合理的是____________;
A.铁质篮球架刷油漆
B.改变金属内部结构制成不锈钢.
C.在地下钢铁管道上连接铜块
③某学生欲探究在NaCl溶液、蒸馏水和空气中铁锈蚀的快慢,设计了如下实验。一周后,实验序号为__________的试管中铁钉锈蚀速度最快。
实验序号 | A | B | C |
实验 内容 |
|
|
|
随着工业发展和社会的进步,人们日益关注环境污染问题。
①下列属于室内空气污染的是____________ (填字母);
A.CO2 B.甲醛 C.N2
②按照垃圾分类的方法,易拉罐瓶属于_______________(填“可回收物”或“可堆肥垃圾”);
③工业废水需处理达标后才能排放。下列废水处理的方法合理的是_______;
A.用氯气除去废水中的悬浮物
B.用中和法除去废水中的酸
C.用混凝剂(如:明矾)除去废水中的重金属离子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现拟分离含乙酸、乙醇和水的乙酸乙酯粗产品,下图是分离操作步骤流程图。在图中圆括号表示加入适当的试剂,编号表示适当的分离方法。

(1)写出各有机物的名称:
A ________________ ;B _____________________;C ____________________ ;
D ________________ ;E ____________________。
(2)写出加入的试剂
(a)是_________________________;(b)是___________________________。
(3)写出有关的操作分离方法
①是_________________,②是__________________,③是__________________。
(4)写出C→D 反应的化学方程式 _____________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com