
【题目】常温下,HCOOH和CH3COOH的电离常数分别1.80×104和1.75×105。将pH=3,体积均为V0的两种酸溶液分别加水稀释至体积V,pH随lg![]() 的变化如图所示。下列叙述错误的是( )
的变化如图所示。下列叙述错误的是( )
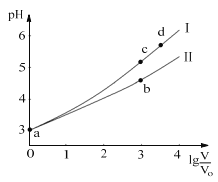
A.溶液中水的电离程度:b点<c点
B.相同体积a点的两溶液分别与NaOH恰好中和后,溶液中n(Na+)相同
C.从c点到d点,溶液中![]() 不变(HA、A-分别代表相应的酸和酸根离子)
不变(HA、A-分别代表相应的酸和酸根离子)
D.若两溶液无限稀释,则它们的c(H+)相等
【答案】B
【解析】
从图中可以看出,随着溶液的不断稀释,Ⅰ的pH大于Ⅱ的pH,则表明Ⅰ的n(H+)小于Ⅱ的n(H+),从而表明lg![]() =0时,Ⅰ对应的酸电离程度大,Ⅰ为HCOOH,Ⅱ为CH3COOH;pH=3时,二者电离产生的c(H+)相等,由于HCOOH的电离常数大于CH3COOH,所以CH3COOH的起始浓度大。
=0时,Ⅰ对应的酸电离程度大,Ⅰ为HCOOH,Ⅱ为CH3COOH;pH=3时,二者电离产生的c(H+)相等,由于HCOOH的电离常数大于CH3COOH,所以CH3COOH的起始浓度大。
A.在c点,溶液的pH大,则酸电离出的c(H+)小,对水电离的抑制作用小,所以溶液中水的电离程度:b点<c点,A正确;
B.相同体积a点的两溶液,CH3COOH的物质的量比HCOOH大,分别与NaOH恰好中和后,消耗的NaOH体积大,所以CH3COOH溶液中n(Na+)大,B错误;
C.对于HCOOH来说,从c点到d点,温度不变,溶液中![]() =Ka(HCOOH)不变,C正确;
=Ka(HCOOH)不变,C正确;
D.若两溶液无限稀释,可看成是纯水,所以它们的c(H+)相等,D正确;
故选B。


科目:高中化学 来源: 题型:
【题目】某校同学设计实验以MgCl2卤液(主要含MgCl2) 为原料制取活性MgO。回答下列问题:
(1)甲组设计下列装置制取氨气和二氧化碳。
①用生石灰和浓氨水制取NH3可选用的装置是_______(填“A”“B”或“AB”)。
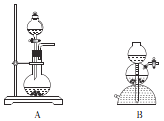
②若用石灰石和稀盐酸制取CO2,反应的离子方程式为_________________________。
(2)乙组利用甲组制备的NH3和CO2制取3MgCO3·Mg(OH)2·3H2O。
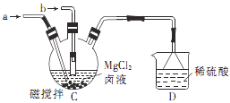
①接口b处通入的气体是_________________(填化学式)。
②装置D的作用是______________________________________。
③生成3MgCO3·Mg(OH)2·3H2O的化学方程式为____________________。
(3)丙组灼烧3MgCO3·Mg(OH)2·3H2O制活性MgO时,所需的硅酸盐质仪器除酒精灯和坩埚外,还需要______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B都是芳香族化合物,![]() 水解得到
水解得到![]() 和1mol醋酸。A、B的相对分子质量都不超过200,完全燃烧都只生成CO2和H2O。且B分子中碳和氢元素总的质量分数为65.2%。A溶液具有酸性,不能使氯化铁溶液显色。
和1mol醋酸。A、B的相对分子质量都不超过200,完全燃烧都只生成CO2和H2O。且B分子中碳和氢元素总的质量分数为65.2%。A溶液具有酸性,不能使氯化铁溶液显色。
(1)A、B相对分子质量之差为____________________。
(2)1个B中应该有____________________个氧原子。
(3)A的分子式为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】瘦肉精,学名盐酸克伦特罗,该药物既不是兽药,也不是饲料添加剂,而是肾上腺类神经兴奋剂,可以增加动物的瘦肉量.减少饲料使用.使肉品提早上市,降低成本,但对人体会产生副作用,盐酸克伦特罗分子结构简式如下图。下列说法不正确的是( )
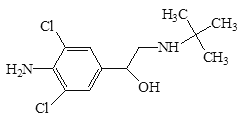
A.瘦肉精的分子式是C11H18ON2Cl2
B.物质能发生取代反应、氧化反应、加成反应和水解反应
C.1mol盐酸克伦特罗最多能与4molNaOH反应
D.盐酸克伦特罗分子中至少有7个碳原子共面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最近科学家获得了一种稳定性好、抗氧化能力强的活性化合物A;其结构如下:

为了研究X的结构,将化合物A在一定条件下水解只得到 和C。经元素分析及相对分子质量测定,确定C的分子式为C7H6O3,C遇FeCl3水溶液显紫色,与NaHCO3溶液反应有CO2产生。
和C。经元素分析及相对分子质量测定,确定C的分子式为C7H6O3,C遇FeCl3水溶液显紫色,与NaHCO3溶液反应有CO2产生。
请回答下列问题:
(1)化合物B能发生下列哪些类型的反应________。
A.取代反应 B.加成反应
C.缩聚反应 D.氧化反应
(2)写出化合物C所有可能的结构简式______________________________。
(3)C可通过下图所示途径合成,并制取冬青油和阿司匹林。

(ⅰ)写出有机物的结构简式:D:______________,C:________________,E:______________。
(ⅱ)写出变化过程中①、⑥的化学方程式(注明反应条件)
反应①__________________________________;反应⑥_____________________________。
(ⅲ)变化过程中的②属于____________反应,⑦属于________反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨是目前最有效工业固氮的方法,解决数亿人口生存问题。回答下列问题:
(1)科学家研究利用铁触媒催化合成氨的反应历程如图所示,其中吸附在催化剂表面的物种用“ad”表示。

由图可知合成氨反应![]() N2(g)+
N2(g)+![]() H2(g)
H2(g)![]() NH3(g)的H=___ kJ·mol-1。该历程中反应速率最慢的步骤的化学方程式为___。
NH3(g)的H=___ kJ·mol-1。该历程中反应速率最慢的步骤的化学方程式为___。
(2)工业合成氨反应为:N2(g)+3H2(g)![]() 2NH3(g),当进料体积比V(N2):V(H2)=1:3时平衡气体中NH3的物质的量分数随温度和压强变化的关系如图所示:
2NH3(g),当进料体积比V(N2):V(H2)=1:3时平衡气体中NH3的物质的量分数随温度和压强变化的关系如图所示:

①500℃时,反应平衡常数Kp(30MPa)___ Kp(100MPa)。(填“<”、“=”、“>”)
②500℃、30MPa时,氢气的平衡转化率为___(保留2位有效数字),Kp=___(MPa)-2(列出计算式)。
(3)科学家利用电解法在常温常压下实现合成氨,工作时阴极区的微观示意如图,其中电解液为溶解有三氟甲磺酸锂和乙醇的惰性有机溶剂。

①阴极区生成NH3的电极方程式为___。
②下列说法正确的是___(填标号)。
A.三氟甲磺酸锂的作用是增强导电性
B.该装置用金(Au)作催化剂目的是降低N2的键能
C.选择性透过膜可允许N2和NH3通过,防止H2O进入装置
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z三种物质直接的转化如图所示,其中不能一步实现的是( )

A | B | C | D | |
X | C | NaOH | CH3CH2OH | N2 |
Y | CO | Na2CO3 | CH3CHO | NH3 |
Z | CO2 | NaHCO3 | CH3COOH | NO2 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,列出10种元素在周期表中的位置。用化学符号回答下列问题:
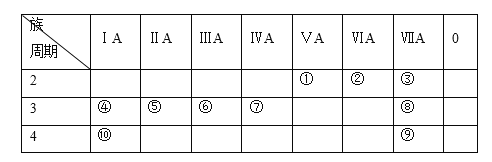
(1)10种元素中,化学性质最活泼的金属是________。
(2)④、⑤、⑥两种元素最高价氧化物对应的水化物中,碱性最强的是________。
(3)③、④两种元素形成的离子,离子半径由大到小的顺序是________。
(4)④和⑨两种元素形成化合物的化学式为________,该化合物燃烧时的焰色为________,该化合物溶液与元素⑧的单质反应的离子方程式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究人员研制出一种新型储备电源-锂水电池(结构如图,高硅铸铁为惰性辅助电极),使用时加入水即可放电。下列关于该电池工作时的说法正确的是
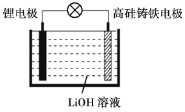
A.高硅铸铁发生氧化反应B.OH-向高硅铸铁电极移动
C.负极的电极反应式为Li-e-=Li+D.电流的方向:锂电极→导线→高硅铸铁电极
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com